NEWS
新闻资讯
|
Nature好文教我们如何玩转RNA与蛋白质互作 | lncRNA Xist与RBPs 调控关系RBPs研究策略 中心法则的思想自提出以来,人们不断探索中心法则中的DNA、蛋白和RNA。由此延伸的技术也是非常非常的多。如DNA由最初的简单基因组测序,到后续研究DNA上的甲基化修饰检测,甚至到了染色质层面的Hi-C组装、染色质功能研究的ChIP等,蛋白研究的蛋白组鉴定、蛋白晶体结构解析等等,RNA上更是非常的多,广为研究的是转录组测序了,任何实验都可能与转录组测序扯上关系。由于测序技术的发展,科研工作者们从探索mRNA功能到现在探索lncRNA、miRNA功能转变,众多小RNA测序结果不断发布发表。大家不仅关注这些ncRNA单独的功能,还关注哪些物质与其互作。 RIP技术的发展,让我们能够更好的去了解与一些蛋白互作的RNA有哪些,CLIP技术及其衍生技术的发展,让我们更能知道蛋白结合RNA的具体位置在哪里。但是,不管是RIP实验还是CLIP实验,我们都需要提前知道研究的蛋白是什么。反过头来,如果我们做了很多的ncRNA测序,知道了一些重要功能的lncRNA,是否也能去实验了解与这些已知功能的lncRNA的互作蛋白呢?答案当然也是yes啦。RAP技术的发展就是为了研究已知RNA,去了解互作的未知蛋白或者DNA(RNA转录调控的下游靶基因)。 通过RIP/CLIP结合RAP,我们完全能全方位深入了解RNA与蛋白以及DNA的互作关系,为一些机制的解析提供了更详细的路径。 根据文献,我们提供了RNA/蛋白互作研究方案,同时根据一篇Nature上的研究的解析来加深这个方案的了解与应用。
发表期刊:Nature 发表时间:2020年9月9日 研究技术:iCLIP-seq、ChIP-seq、RAP-seq、CO-IP、RNA FISH、EMSA等 研究背景雌性哺乳动物细胞拥有两条X染色体,在发育过程中其中的一条会失活,以此来平衡雌性与雄性间的基因表达剂量。长链非编码RNA Xist通过高浓度定位于其转录位点附近的区域,并结合不同的蛋白建立一个染色体内包膜室来实现x染色体失活(XCI)。因此,XCI过程是理解RNA介导的各种蛋白质招募如何诱导功能的一个范例。因为在最初的Xist扩散和转录关闭之后,基因沉默会达到一种状态,即使Xist被关闭,基因沉默也会保持稳定。 研究结果xist RBPs PTBP1、MATR3、TDP-43和CELF1聚集在Xist的多价E-repeat元件上,通过自聚集和异型蛋白-蛋白相互作用,在Xi中形成一个冷凝物。这种凝聚对于基因沉默和Xist锚定到Xi区域是必需的,并且在Xist缺失的情况下也能维持。值得注意的是,这些e -repeat结合蛋白在过渡到XCI独立存在相时是必需的,表明E-repeat所介导的凝聚是xist依赖转向xist非依赖的开关。最终结果表明xist通过形成包含广泛存在的RBPs的杂聚肽聚集物形成Xi复合物,揭示了遗传基因沉默的意外机制。 文章思路
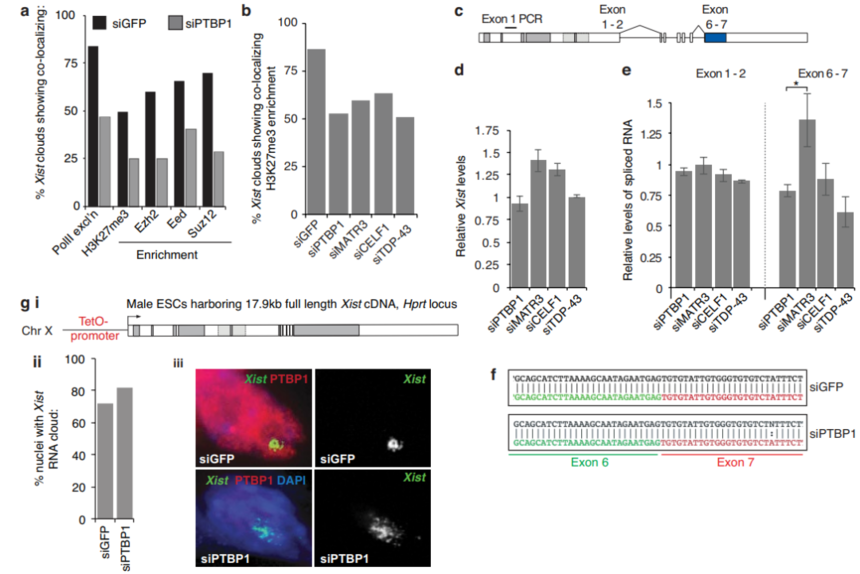
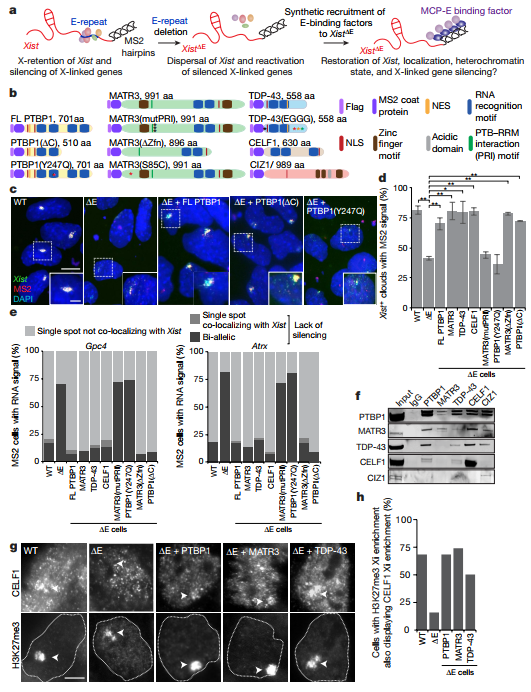
研究结果1、检测PTBP1、MATR3、CELF1或者TDP-43缺失是否影响xist定位(siRNA KD) ES雌性细胞中相关蛋白的敲除实验后,WB、免疫荧光染色、RNA FISH实验显示核扩散现象明显,并且依赖xist的Xi标记物H3K27me3缺少,同时xist的转录本或者剪接水平只轻微的改变。这些结果表明这四种RBPs介导Xi形成中的Xist定位,并且这种进程是独立于RNA表达进程。
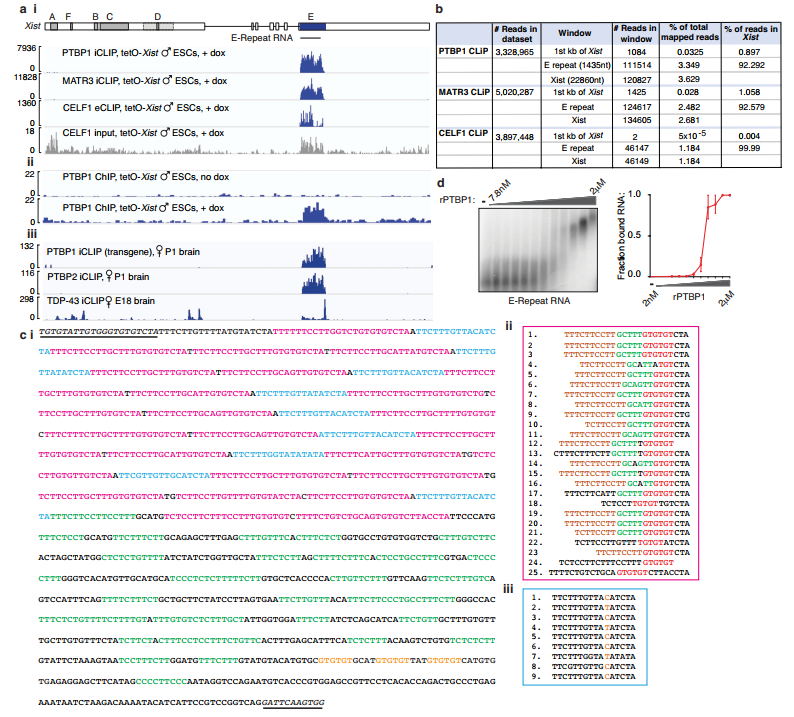
2、检测这些RBPs结合在Xist的什么位置 作者在XCI初始阶段分别做了CLIP-seq实验,结果发现四种RBPs都在xist的E-repeat上结合,这个E-repeat上包含至少50种富含CU和G的元件。EMSA实验证实PTBP1结合RNA的E-repeat区域。PTBP1的ChIP-seq实验发现PTBP1的peak区域位于基因组的E-repeat区域且在Xist诱导表达时出现,这种现象表明PTBP1与xist协同转录。在不同细胞中PTBP1和PTBP2的xist CLIP-seq实验都表明其能结合E-repat,同时TDP-43在胚胎小鼠大脑中的CLIP-seq实验表明其能结合E-repeat的3’末端。总的来说,这些结果都表明PTBP1、MATR3、CELF1或者TDP-43都能结合E-repeat且XCI启动完成后,他们仍然与E-repeat结合,同时,PTBP1同家族蛋白能取代PTBP1 的位置。
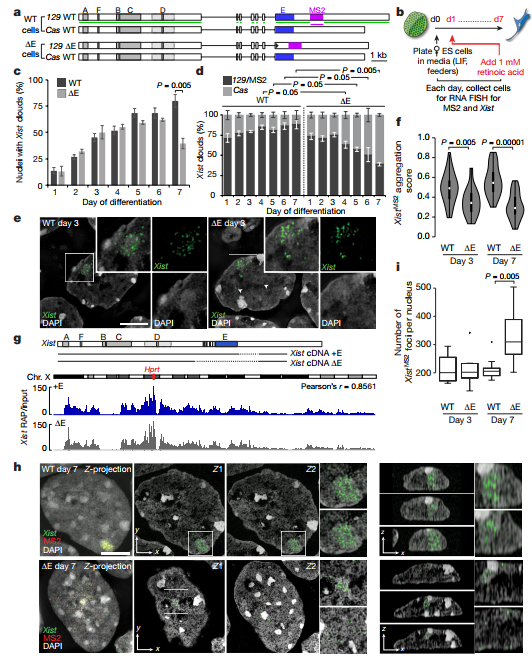
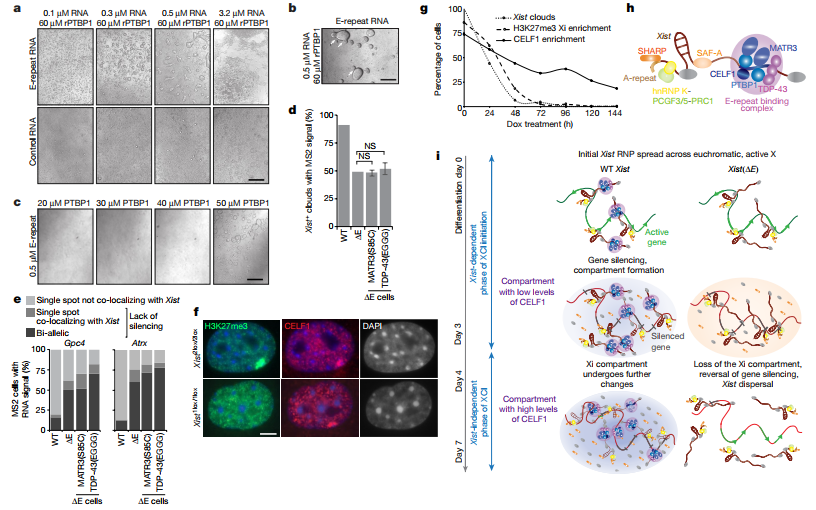
3、检查在XCI起始以及三天后XCI过渡到不存在相后是都能通过显微镜观察到Xi中xist招募PTBP1、MATR3、CELF1或者TDP-43的现象 在雌性ES细胞中观察到CELF1在Xi中的积累并且在3天到7天中CELF1的积累增强。在不同的细胞中都观察到细胞分化7天后的PTBP1在Xi区域中的网格状定位。MATR3、TDP-43和PTBP1在大多数细胞Xi中都不富集,但是它们并没有耗尽。因此作者认为在Xi区域,PTBP1、MATR3和TDP-43是已经存在,CELF1逐渐积累。 4、假设E-repeat的缺失会通过减少xist在x染色体区域富集从而影响XCI 为了验证假设,作者在129位等位基因(它包含11个MS2标签拷贝)处删除xist的E-repeat,敲除的株系命名为ΔE ES 细胞。RNA FISH实验显示在野生型和ΔE细胞中,xist包裹的X染色体的数量直到分化4天都是逐渐增加。相对于野生型,ΔE细胞中xist的富集之后下降,在第7天显著减少近50%,这种情况在ΔE细胞中尤为特别。MS2标签的RNA FISH实验显示在野生型和ΔE中,无论是xist的丰度还是其半衰期都无明显差别。含Xist初期转录位点却不含XIST cloud的探针的RNA FISH实验显示Xist RNA包裹Xi。因此,在ΔE细胞中Xist积累的减少并不是Xist丰度降低、剪接缺陷或RNA稳定性降低的结果。进一步观测发现相对于野生型,ΔE细胞在xist定位上仅有中度缺陷。RAP-seq实验发现野生型和ΔE细胞中在X染色体中Xist的高度关联,表明E-repeat并不参与Xist在X染色体上的初始转移。然而,在7天后,作者发现相对野生型,ΔE细胞中细胞核内定位于核纤层的Xist的显著分散。高分辨率的3D-SIM成像进一步显示相对于野生型,ΔE细胞分化7天后Xist的数量显著增加,但是在分化3天时并未发现差异。同时,野生型和ΔE细胞中xist 转录本并未有差异。这些结果表明了E-repeat对于多个Xist转录本整合成成熟xist个体是必需的,并且能够稳定这些在X染色体复合物中的位点。分化7天时,在Xist定位的地方,作者发现了低H3K27me3富集,并且在Xi区域内发现了染色质凝集现象减少。随着Xi中PRC2复合物富集的减少,Xist定位现象增加,这个情况表明它涉及到X染色体复合物的重组。总而言之,这个结果表明了一个转变机制:在XCI起始阶段X染色体中Xist的富集是从大量E-repeat独立阶段转向E-repeat依赖结算开始。
5、探索X相关联基因沉默是都是由E-repeat元件缺失引起 RT-qPCR表明野生型和ΔE细胞中早期分化时与XCI关联基因Gpc4、Rnf12、Mecp2、Chic1和Atrx并无明显差别,但是在分化晚期(4-7天),ΔE细胞中这5个基因的基因沉默难以维持。此外,RNA聚合酶II在早期分化时与Xist分离,但是在晚期与Xist混合在一起。因此,E-repeat对于维持Xist外衣、X关联基因沉默以及排除RNA Pol II超出最初的转录关闭波很重要。这些结果表明在没有E-repeat的情况下,XCI启动时Xist的独立状态无法建立,这表明E-repeat参与了Xist基因沉默的表观遗传记忆的生成。
6、证实E-repeat结合蛋白、Xist定位以及基因沉默之间存在因果关系 在ΔE细胞中融合表达PTBP1、MATR3、CELF1和TDP-43与MS2外衣蛋白MCP。检测在过表达细胞中分化7天的Xist定位、Gpc4、Rnf12、Mecp2、Chic1和Atrx基因沉默情况以及H3K27me3富集情况,结果表明E-repeat通过与蛋白PTBP1、MATR3、TDP-43和CELF1互作来控制Xist定位、基因沉默和异染色质形成。 7、验证蛋白PTBP1、MATR3、TDP-43和CELF1是否共同调控XCI进程 实验表明MCP-MATR3结合PTBP1-RRM互作序列并且招募H3K27me3富集,但是不能挽救由于E-repeat缺失造成的Xist定位和基因沉默缺陷。247位Tys突变成Gln后PTBP1与MATR3不互作。Co-IP实验证实在RNA存在时,PTBP1、MATR3、CELF1和TDP-43有互作,但是在RNase处理后,只有PTBP1和MATR3结合。这些结果表明PTBP1和MATR3对XCI是必需的,而且这些蛋白在XCI进程中无冗余作用。另外,ΔE细胞表达MCP-PTBP1、MCP-MATR3、MCP-CELF1和MCP-TDP-43时CELF1在Xi中富集表明这些RBPs中的每一个都能在Xi中启动异质蛋白组合的形成。有报道CIZI能结合E-repeat,并且PTBP1和MATR3能与CIZI互作,但是在ΔE细胞中过表达MCP-CIZI时并未发现Xist形成或者X关联基因沉默。此外,在野生型细胞中发现Xi中CIZI富集,但是在过表达MCP-PTBP1、MCP-MATR3或MCP-TDP-43的ΔE细胞中并未检测到。这表明PTBP1、MATR3、CELF1和TDP-43引起的Xist现象是不依赖于CIZI的,同时它们在E-repeat上组装成特有的功能复合物。ΔE细胞中过表达二价复合物MCP-GFP-MCP融合蛋白并不能招募Xist定位或者沉默缺陷,进一步说明四种蛋白世系形成并非简单的与Xist转录本连在一起。
8、检验招募的蛋白是否都有其他特异性活动来促进Xist功能分化以及下游XCI事件 作者发现ΔE细胞中敲除MATR3中的锌指结构域后并不影响xist功能。ΔE细胞中PTBP1缺失RRMs3和4能引起E-repeat的缺失,进一步观察发现该缺失细胞中xist在核内位置分散。这些发现表明结合元件是作为PTBP1-Xist的功能元件共价结合组装。 9、探寻rPTBP1在体外与Xist的E-repeat反应时是否形成液滴 3.2 μm E-repeat RNA加入60uM的rPTBP1能够形成类似聚合体组件,而低浓度RNA (0.1 ~ 0.5 μm)的加入,则产生类似相分离液体的液滴,并可相互融合。相反,包含5个短的CU并且能与PTBP1结合的对照RNA只产生小液滴,并且并未在更高浓度RNA时出现聚集现象。这些发现表明PTBP1多价结合E-repeat。在接近生理浓度的rPTBP1 (20-40 μm)没有形成液滴,这表明额外的蛋白促进了体内E -repeat诱导的PTBP1的冷凝,这与MATR3、PTBP1、CELF1和TDP-43功能的相互依赖是一致的。通过在0.5 μm E-repeat RNA加不同浓度的rPTBP1中加入20 μm rCELF1,结果在高浓度rPTBP1中发现有聚集现象,浓度降低聚集团直径变小直到20 μm时变成小液滴。这些观察结果与Xi中通过多个RBP与E-repeat的多价结合形成的高阶蛋白凝析物的形成一致,并表明多个RBP的参与降低了凝析诱导所需的每个因素的浓度。体外实验表明E-repeat互作蛋白需要这些蛋白在XCI中行使功能。TDP-43的体外液滴实验也有相似的结果。作者得出结论,通过与E-repeat的高密度结合,xist浓缩了PTBP1、mat3、TDP-43和CELF1,这些基因利用同型和异型相互作用建立一种物理凝析物,将xistr分隔开来,并执行x -连锁基因沉默。
10、验证观点:在Xi中蛋白复合物PTBP1、MATR3、TDP-43和CELF1形成后,Xist缺失了也会保留 结果表明CELF1在原代雌性小鼠胚胎成纤维细胞Xi中富集时携带一个条件Xist等位基因。当Xist缺失时,随着时间的推移,H3K27me3的xi积累的丢失与Xist的丢失密切相关。值得注意的是,即使Xi中富集了Xist或H3K27me3后无法检测到,仍有25-40%的细胞中存在CELF1富集。CELF1富集依赖于PTBP1、MAT3和TDP-43,因为在没有Xist的情况下,TDP-43的消耗导致更少的细胞有CELF1 xi的积累。 研究结论作者证明E-repeat直接与RBPs PTBP1、MAT3、TDP-43和CELF1结合,并且将这些蛋白带入Xist结构域。这些因子每个都携带多个RRMs,这些RRMs可能允许E-repeat中不同的重复基序同时参与,或在单个转录本之间,潜在地增加了与Xist结合的潜力。Xist RNA结合蛋白PTBP19、mat310、TDP-4311和CELF112在Xist的多价E-repeat元件上组装,并通过自聚集和蛋白-蛋白相互作用,在Xi中形成一个缩合蛋白。这种凝聚对于基因沉默和Xist锚定到Xi区域是必需的,并且在Xist缺失的情况下也能维持。值得注意的是,这些E-repeat结合蛋白与XCI相独立的XCI相过渡是必需的,这表明E-repeat所产生的凝析体是由XCI依赖相到XCI非依赖相发育转变的基础。总的来说,作者的结果表明,Xist通过形成由普遍存在的RNA结合蛋白组成的异质冷凝物形成Xi隔间,揭示了遗传基因沉默的一个意想不到的机制。 文献来源:DOI: 10.1038/s41586-020-2703-0 |