NEWS
新闻资讯
|
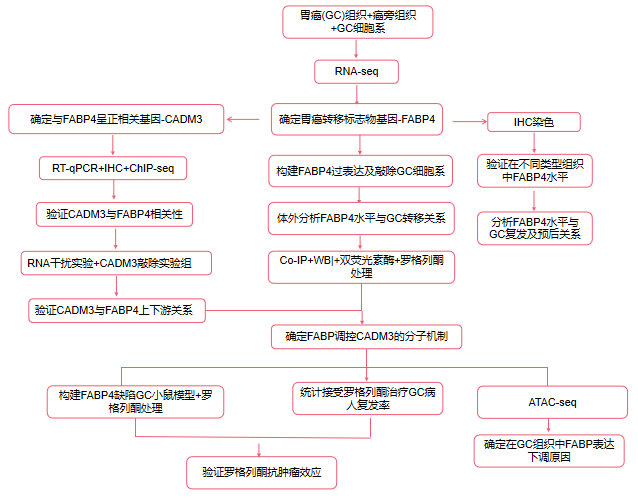
项目文章 | IF:11.6! ChIP-seq助力揭示罗格列酮抑制FABP4缺陷型胃癌肿瘤转移的机制发表单位:福建医科大学附属协和医院 01 研究背景 02 文章思路
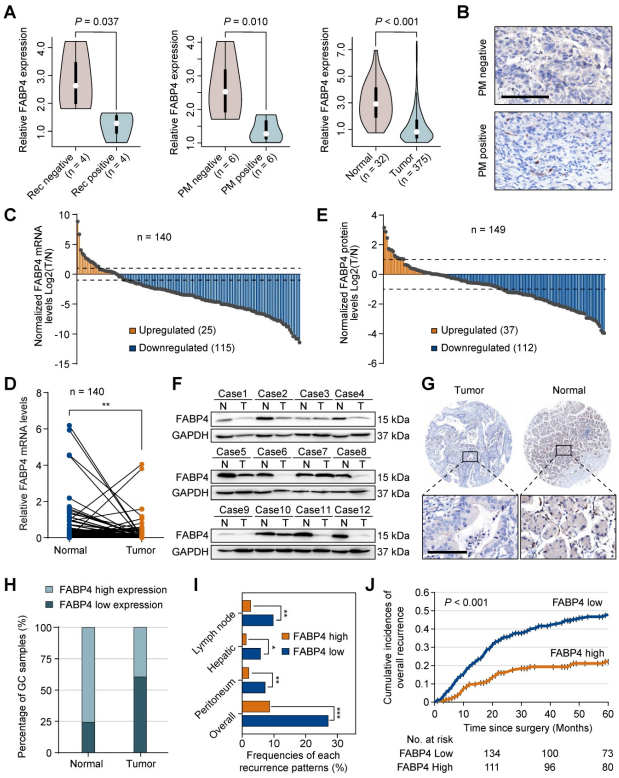
03 结果 01 FABP4下调与GC患者生存期降低和复发率增加相关
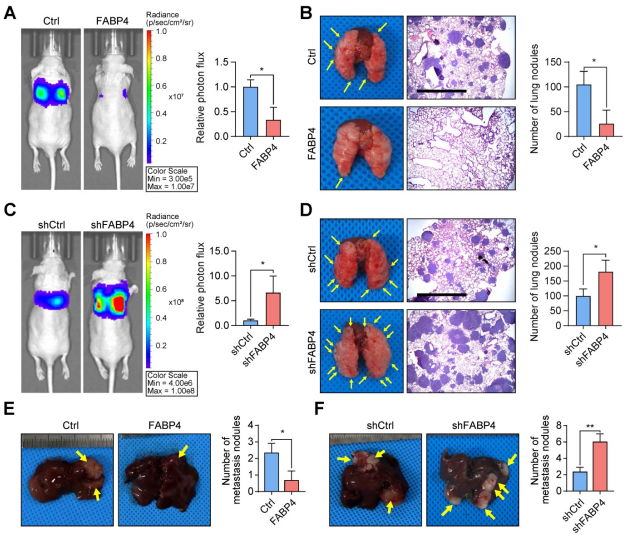
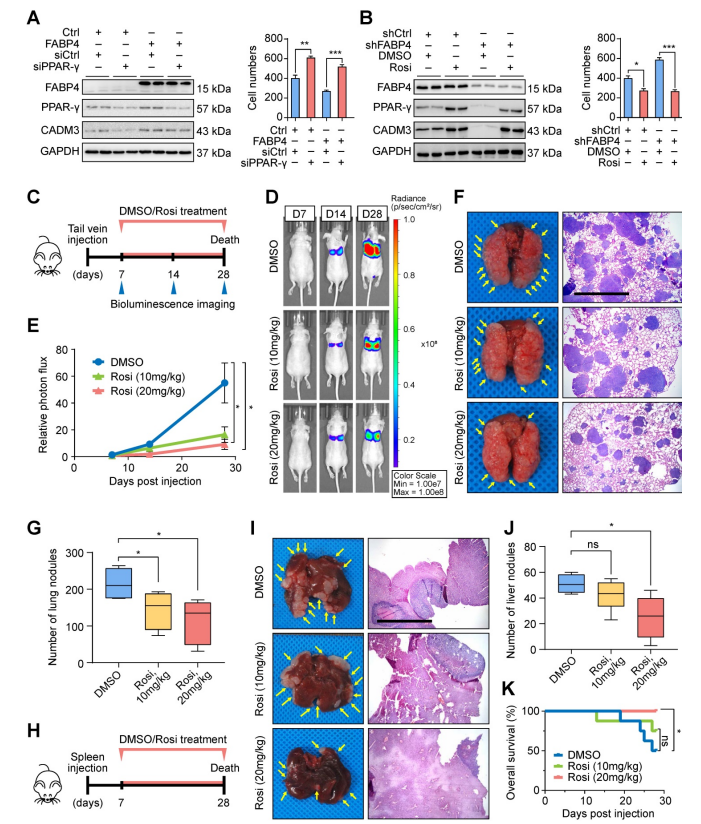
02 FABP4在体外和体内均可减弱GC转移
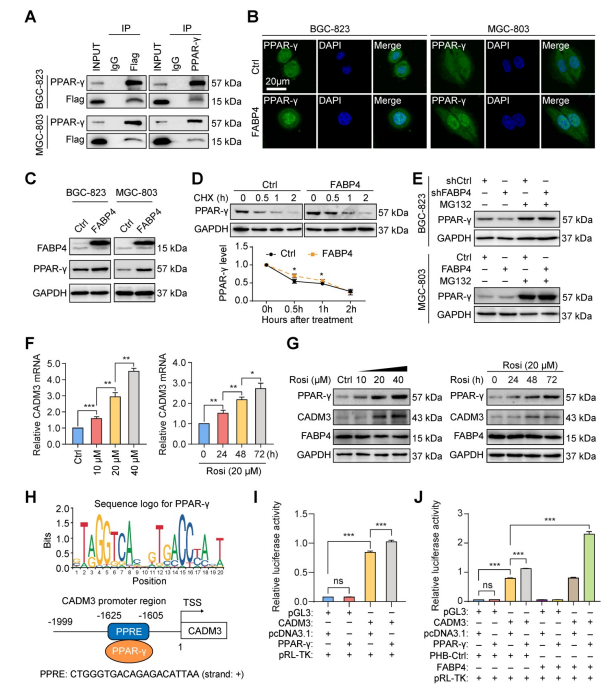
03 CADM3是FABP4的关键功能靶点 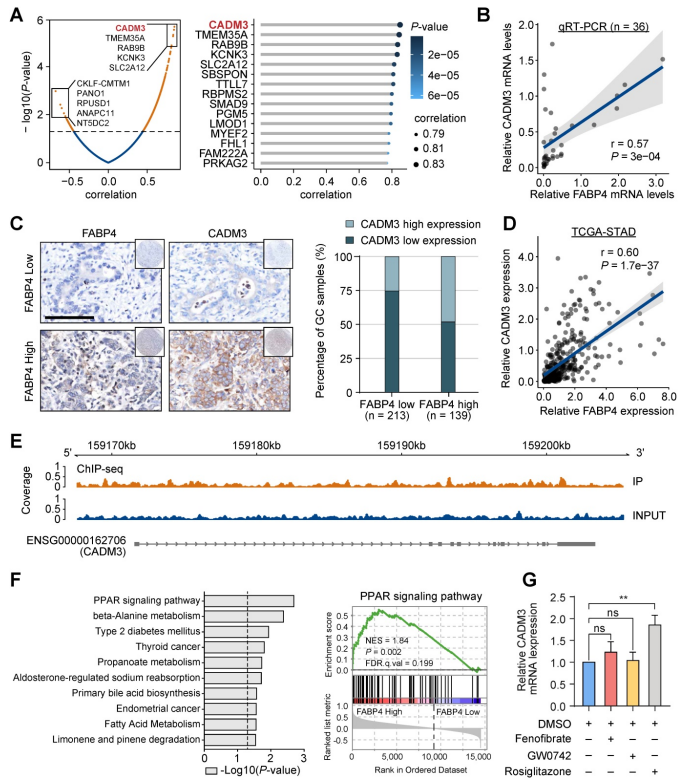 04 FABP4促进核受体PPAR-γ调控CADM3表达
图4 FABP4促进PPAR-γ介导的CADM3转录 05 罗格列酮是一种治疗FABP4缺陷GC的潜在抗肿瘤药物
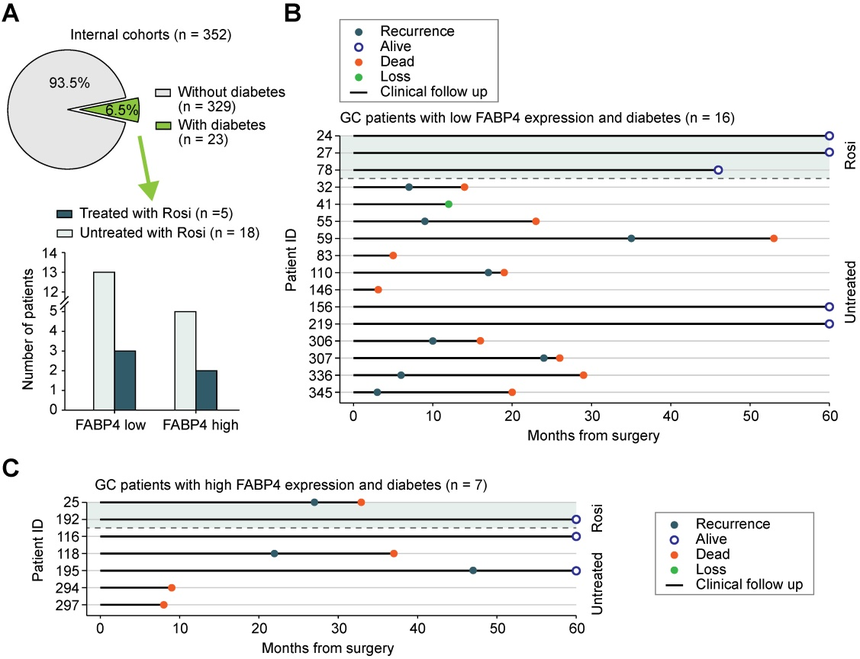
06 罗格列酮治疗与GC患者复发风险的相关性
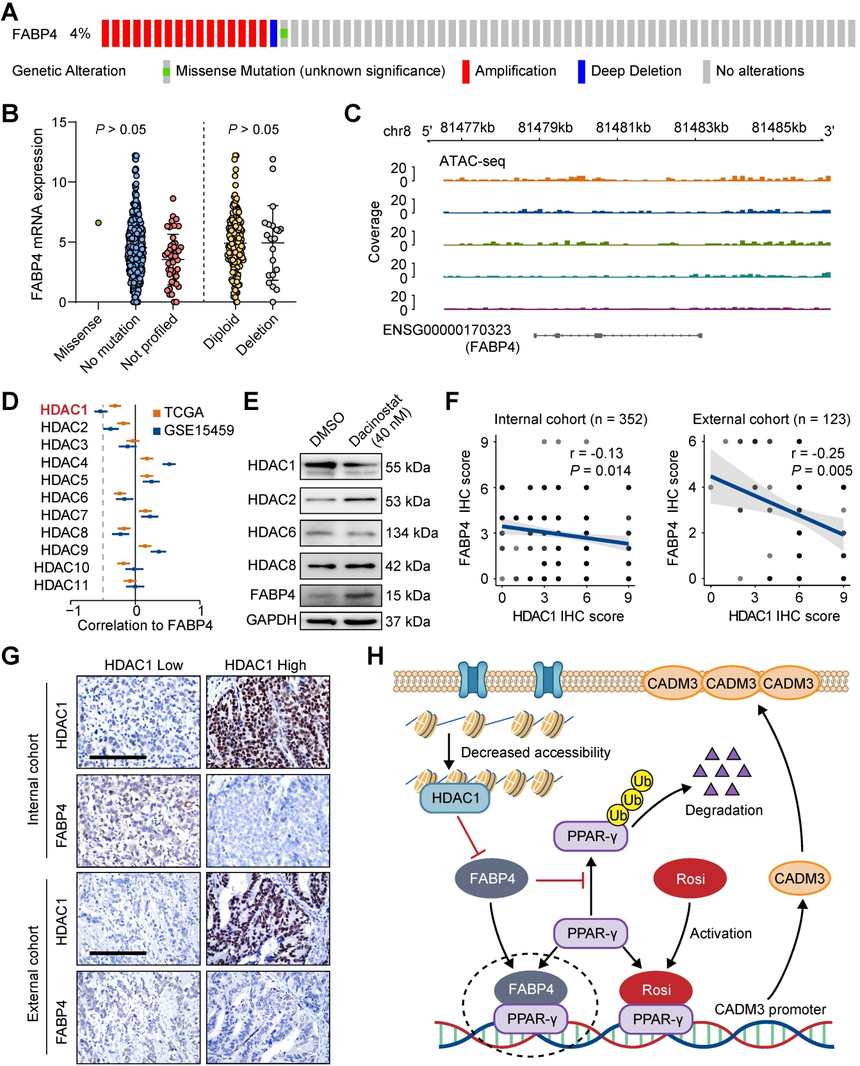
07 染色质不可接近可能通过HDAC1过表达而降低FABP4的表达
04 结论 |