NEWS
新闻资讯
|
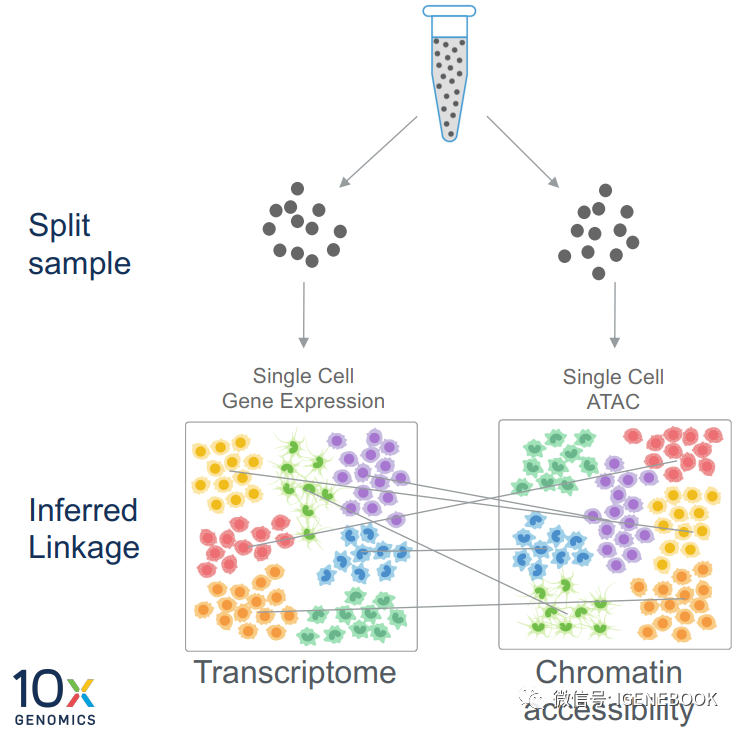
单细胞多组学scRNA+scATAC实验策略选择单细胞实验除了有单细胞转录组、单细胞ATAC、单细胞CUT&tag、单细胞TCR/BCR、单细胞甲基化、单细胞基因组等,多个组学联合实验及分析一直是人们应用的主题,并且也有很多单细胞多组学文章的发表,但是对于大规模细胞实验,鉴于成本考虑,能选择的多组学不多。 商业化的多组学应用莫过于scRNA+scATAC技术。 在scRNA+scATAC技术联合上,也有一段发展历程,Z初人们进行技术联合时,主要是单独进行scRNA-seq和scATAC-seq实验,得到两组分别实验的数据,之后再对两组数据进行整合分析,分析策略上也有很多人进行软件开发应用,但是大致思路是基于这样的前提: 1、开放染色质区域与基因表达呈现正相关; 2、染色质开放促进基因表达; 3、非启动子区域的开放性被丢弃;
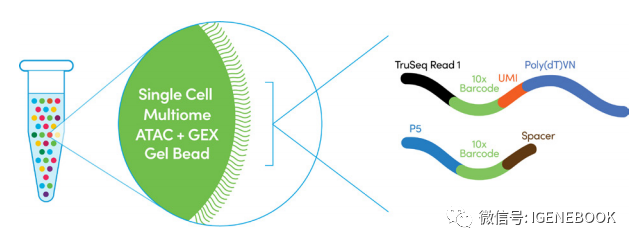
基于这样的联合分析,将scRNA的每个细胞的基因表达与scATAC的每个细胞的开放染色质状态进行一一对应,以此来进行细胞关联,得出同一细胞的基因表达和开放染色质状态,但是有一些细胞没有办法进行对应或者对应的细胞是错误的。 考虑到这样的情况出现,10x Genomics公司进行了技术革新,推出了Chromium single cell multiome ATAC+ Gene expression的策略,在同一beads上含有捕获mRNA的探针和捕获tn5特异序列的探针,这样在实验层面上就能解决同一细胞来源问题。
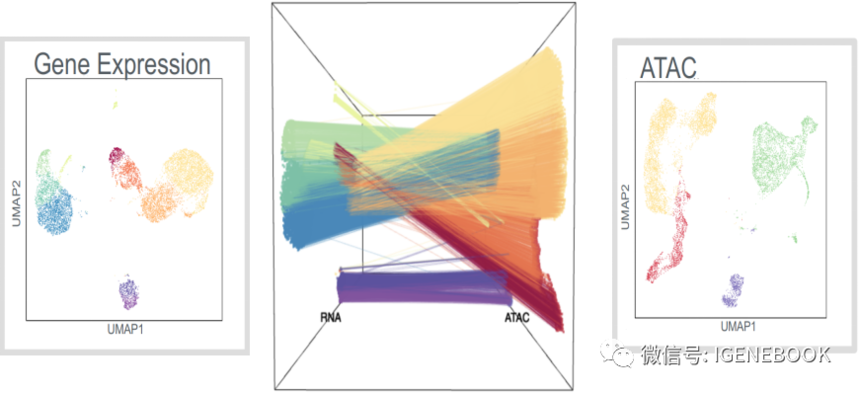
这样在分析时,可以根据barcode信息就能知道基因表达情况和开放染色质情况来源于哪个细胞,很好的解决了之前的争议部分。
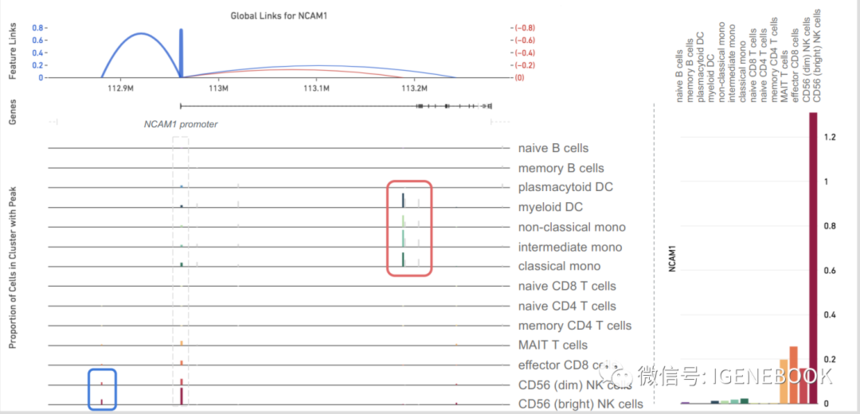
有意思的是,基于这样的思路进行的实验,后续分析时发现,转录因子并不只是促进基因的表达,有可能会降低基因的表达,这样的数据整合,就能知道在细胞异质性调控过程中,关键转录因子的更具体调控机制:促进哪些基因的转录、抑制了哪些基因的转录,再对这些基因进行功能注释从而进行了解其参与调控通路,perfect!
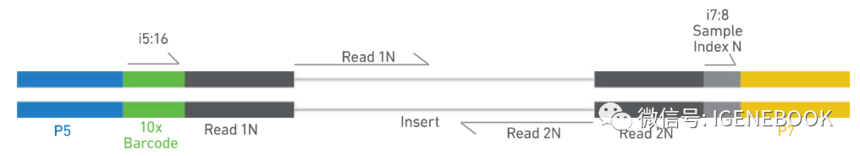
在实际实验过程中,Z好是选择scRNA-seq+scATAC-seq同时实验的策略么? 也不是的,得具体根据老师的经费考量来进行。我们要知道,scATAC-seq技术在实验时是首先提取细胞核,在进行tn5酶切孵育,孵育之后在进行上机单细胞捕获,这时,样本tn5酶切是否充分不到Z后文库构建是不得而知的。这样一次实验同时捕获scRNA数据和scATAC数据时,如果scATAC实验因为tn5酶切原因导致实验失败,那么scRNA-seq的结果也造成了浪费。再者,老师如果关系细胞质中的转录本信息,那么一次实验同时捕获的策略也不适用。 另外,从文库结构上,单独进行scATAC实验时,scATAC的文库结构如下:
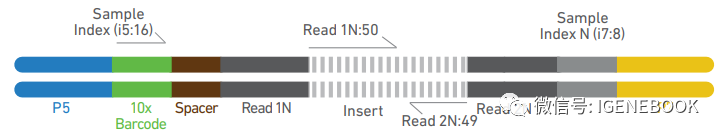
在i5端,10x barcode长度为16 bp,基于目前国内测序平台主要以Illumina公司的nova 6000为主,价格上也是nova 6000更有优势,有些测序公司也会去尝试调整i5端16 bp index长度的策略将scATAC文库与其他文库混合后在nova 6000上进行测序,这样整个文库测序价格也能够更低(毕竟单细胞实验单个样本的测序量都不低)。 而同时实验时,scATAC的文库结构如下:
在i5端,10x barcode+spacer的长度就变成了24bp,即在测序时,我们需要将i5端index长度调整为24 bp,目前nova 6000上除非直接整条lane都来测scATAC的文库,不然只能选择其他平台进行测序,那么整个测序价格也会更昂贵。 怎么选择实验策略大家了解清楚了么? 不同型号显微镜进行悬液质控:普通光学显微镜、荧光显微镜、荧光计数仪; 配备组织解离仪、流式分选仪,满足不同样本悬液制备需求; 大的服务器集群,可并行处理125个样本的单细胞数据; 优秀的单细胞专业实验人员及单细胞生信分析人员,负责单细胞个性化实验及单细胞个性化分析需求; scCUT&tag获武汉市科技局创新项目资助。 |