NEWS
新闻资讯
|
客户文章 | IF =8.469 ! ChIP-seq助力中山大学生科院发表小鼠脂肪的潜在肥胖治疗靶点
发表单位:中山大学生命科学学院 发表日期:2021年7月2日 期 刊:Cell Death & Disease(IF:8.469) 2021年7月2日中山大学生命科学学院陈瑶生和莫德林教授团队在期刊Cell Death & Disease(IF:8.469)发表题为“HMGB2 orchestrates mitotic clonal expansion by binding to the promoter of C/EBPβ to facilitate adipogenesis”的研究论文。该研究不仅发现小鼠HMGB2能够促进脂肪生成,而且利用ChIP-seq技术筛选到靶基因。在小鼠中HMGB2通过结合 C/EBPβ的启动子协调有丝分裂克隆扩增,促进脂肪生成。该研究提供了HMGB2-C/EBPβ轴的新机制以及肥胖的潜在靶点。爱基百客为其提供ChIP-seq的技术支持。
研究背景 C/EBPβ(CCAAT/enhancer-binding protein-β)是亮氨酸zipper家族成员,已被证实在早期脂肪形成中扮演重要角色。正常情况下,C/EBPβ在激素诱导剂诱导的3T3-L1融合后迅速激活,随后反式激活过氧化物酶体增殖物激活受体γ(PPARγ)和 C/EBPα的表达。然后,它们都激发了脂肪生成相关的因子,这些因子对脂质的形成和积累是必要的。HMGB2(高迁移率族蛋白B)是一种丰富的染色质相关蛋白,在调控转录、细胞增殖、分化和肿瘤发生中发挥重要作用。作者之前的研究发现HMGB2在皮下和肌内间质血管细胞中均有较高表达。诱导脂肪形成后,它就大幅减少。然而,HMGB2在脂肪形成中的潜在机制尚不清楚。 研究思路
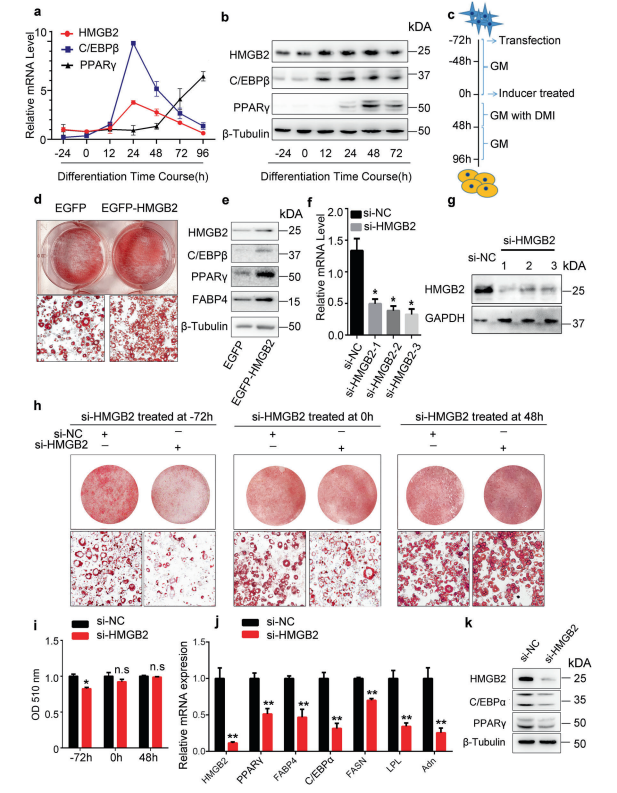
研究结果 1. HMGB2是前脂肪细胞分化所必需的 为了了解HMGB2在脂肪形成中的作用,作者检测了HMGB2、C/EBPβ以及PPARγ的内源性表达谱。结果显示HMGB2和C/EBPβ的mRNA水平在DMI(激素诱导剂)诱导后迅速增加且在24h达到高峰,然后逐渐减少,而PPARγ在脂肪形成后期表达(图1. a和b)。这一结果暗示HMGB2的表达趋势与C/EBPβ类似,而不是PPARγ。超表达HMGB2(图1. c),3T3-L1细胞表现出增强的成脂能力,伴随着甘油三酯形成、脂质积累和成脂因子(包括C/EBPβ、PPARγ和FABP4)上调表达;这一结果由油红O染色、western blot实验确认(图1. d和e)。 相反,在3T2L1细胞中进行3个单独的油红O染色实验,结果表明在DMI诱导前-72h敲除HMGB2能够显著抑制脂肪细胞分化和脂质积累,而在DMI诱导后0或48h干预HMGB2则对脂肪形成没有效果(图1. f-h),由光密度(OD)检测证实(图1. i)。此外,在-72h敲除HMGB2抑制终端脂肪形成基因的表达,这些基因有C/EBPα、PPARγ和FABP4等(图1. j和k)。这些结果证明HMGB2仅在早期分化阶段影响脂肪形成。总而言之,这些结果暗示HMGB2是脂肪形成所必需的。
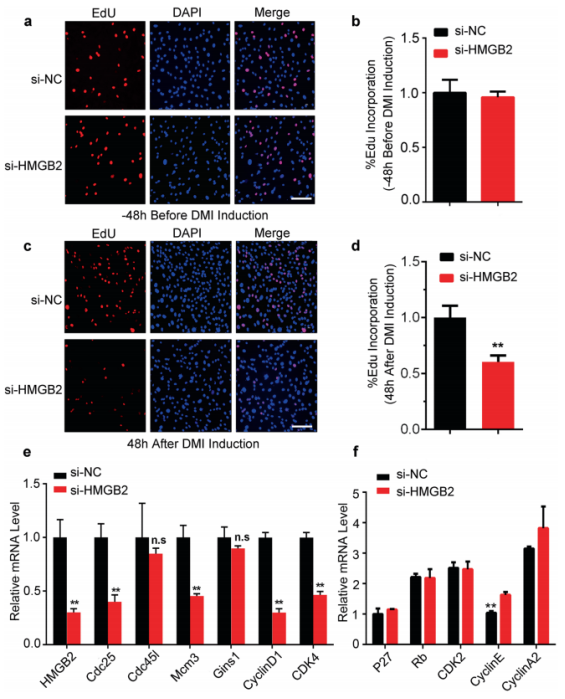
图1. HMGB2是脂肪形成所必需的 2. HMGB2仅参与脂肪形成的有丝分裂克隆扩增期(MCE) 尽管上述结果暗示HMGB2在早期分化阶段影响脂肪形成,但HMGB2如何调控早期脂肪的机制仍然不清楚。为了弄清这点,在不同时期进行5‐乙炔基‐2′‐脱氧尿苷(EdU)核素掺入实验,检测在不同阶段敲除HMGB2对细胞增殖的干扰效果。结果是在-48h(正常细胞增殖周期) EdU阳性细胞的百分比没有任何变化(图2. a和b)。然而,在MCE(mitotic clonal expansion,有丝分裂克隆扩增)时期(DMI诱导48h后)监测时,同一时期(-72h)si-HMGB2(HMGB2的RNAi载体)处理后EdU阳性细胞的比例显著减少(图2. c和d)。另外,MCE特异基因(Mcm3、Gins1、CyclinD1和CDK4)的mRNA水平在敲除HMGB2后可以预见地减少(图2. e)。然而,正常细胞增殖时表达的细胞周期基因(在−48 h检测)不受HMGB2敲除的影响(图2. f)。以上这些结果暗示HMGB2特异调控MCE。
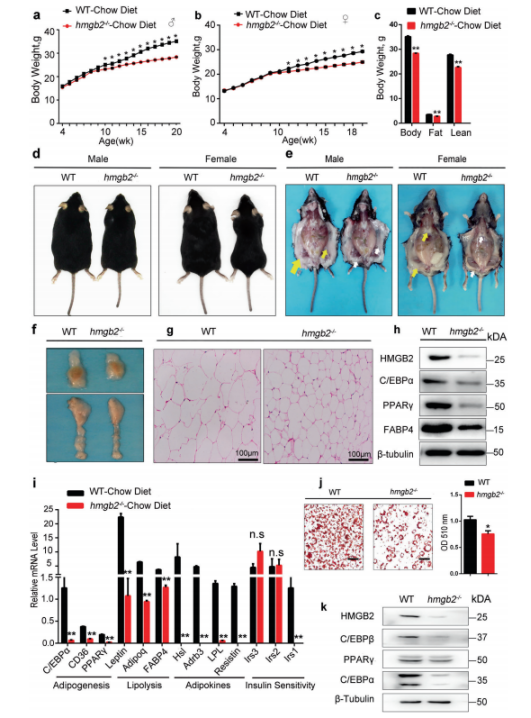
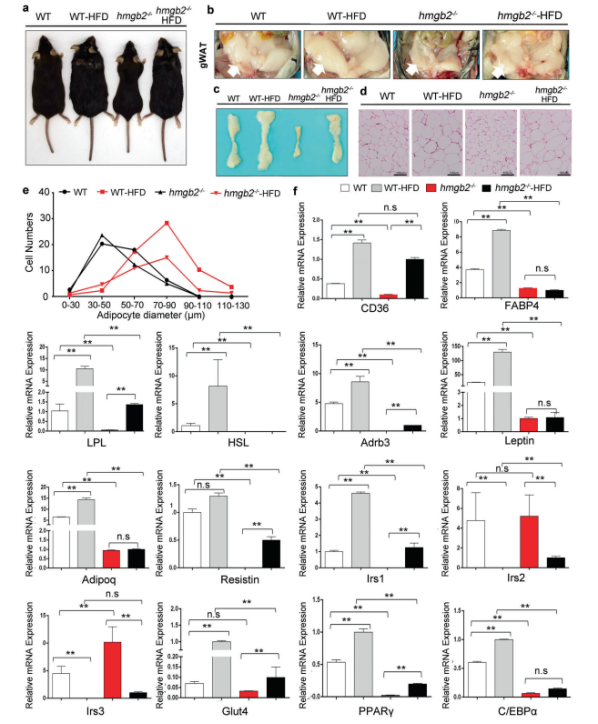
3. HMGB2缺失可抑制体内脂肪形成 利用CRISPR-cas9技术构建hmgb2-/-小鼠。与野生型小鼠比较,喂食鼠粮的hmgb2-/-小鼠从出生到10周大没有明显的体重差异。然而,10周后hmgb2-/-小鼠表现出更低的体重,雄性和雌性皆如此(图3. a和b)。为了比较WT和hmgb2 - / -小鼠脂肪沉积相关表型性状的差异,作者在12周时从小鼠上分离脂肪和肌肉组织并且称重。不出所料,作者发现hmgb2-/-小鼠的脂肪和瘦肉体重均明显地下降(图3. c)。同时,hmgb2-/-小鼠表现出更小的身材尺寸(图3. d),并伴随着更小的脂肪组织细胞堆积(图3. e)。此外,腹股沟和附睾脂肪解剖图暗示HMGB2缺失抑制脂肪沉积(图3. f)。 H&E染色结果证明hmgb2-/-小鼠白色脂肪组织的脂肪细胞尺寸明显变小了(图3. g)。与此一致的是,HMGB2缺失导致C/EBPα、PPARγ和FABP4的表达减少,这些基因本应该在终端脂肪细胞分化中高表达(图3. h)。qPCR实验也证明在HMGB2缺失后,除了lrs2和lrs3基因,脂肪形成相关基因、脂肪分解相关因子、脂肪因子相关基因和部分胰岛素(INS)敏感相关基因表达下调(图3. i)。此外,hmgb2-/-小鼠腹股沟白色脂肪衍生的间质血管组分(SVFs)成脂能力也减弱(图3. j)。Western blot实验证实脂肪形成基因C/EBPα、PPARγ和C/EBPPβ的表达水平减少了(图3. k)。因此,体内HMGB2缺失导致小鼠体重下降,脂肪库尺寸变小,成脂潜力减弱,伴随着成脂基因表达降低。
4. 高脂饮食(HFD)能增强hmgb2 - / -小鼠的成脂能力,但速度较低 为了评估hmgb2-/-小鼠对营养过剩状况的反应,进行了HFD喂养。结果显示,HFD喂养的hmgb2-/-小鼠体重、脂肪和瘦体重以及体型均有所增加,但小于喂食HFD的WT小鼠H(图4. a)。组织学结果表明hmgb2-/-小鼠的腹部和腹股沟的白色脂肪最小(图4. b)。当喂食HFD时,hmgb2-/-小鼠的脂肪垫增加,但小于喂食HFD的野生型小鼠(图4. b和c)。此外,脂肪肝只出现在喂食HFD的野生型小鼠中,这意味着体内敲除HMGB2会导致肝脂肪组织形成受损,即使喂食HFD。腹部和腹股沟白色脂肪的H&E染色结果表明喂食HFD的hmgb2-/-小鼠的脂肪细胞尺寸明显大于喂食鼠粮的hmgb2-/-小鼠,甚至比用鼠粮喂养的野生型小鼠更大(图4. d),脂肪细胞直径统计数据进一步证实这一结果(图4. e)。HFD喂食可以显著提高hmgb2-/-小鼠的成脂基因(PPARγ、C/EBPα、LPL、lrsl和Glut4)的表达,但仍然低于喂食HFD的野生型小鼠(图4. f)。总之,HFD促进hmgb2-/-小鼠的成脂能力,但没有达到野生型小鼠的水平。
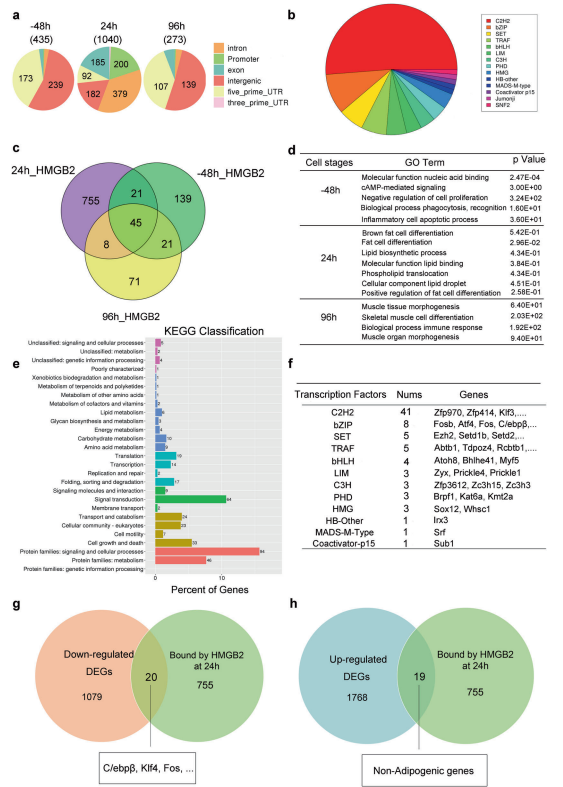
图4. HFD增加hmgb2-/-小鼠的成脂能力但以较低的速率增加 5. MCE时期HMGB2靶基因的筛选 为了筛选与HMGB2结合的靶基因,作者分别收集了相对于DMI诱导的-48h(增殖阶段)、24h(MCE时期)和96h(分化时期)3T3-L1细胞进行ChIP实验。结果表明HMGB2结合位点的分布在MCE时期、细胞增殖期和终端分化时期有明显差异(图5. a)。此外,HMGB2在MCE阶段的结合位点是其他阶段的3倍左右,这些位点主要分布在启动子、外显子和内含子上,这些位点是转录因子的主要结合区域。HMGB2靶基因的结合峰分类显示HMGB2与C2H2、bZIP、bHLH、HMG等转录因子家族高度结合(图5. b)。这些因子中,C/EBPβ属于bZIP转录因子家族。根据在三个不同时期的HMGB2靶基因韦恩图,MCE时期的靶基因数目远超过-48h和96h时期,其中仅在MCE时期(24h)发现了755个基因(图5. c)。这一结果暗示HMGB2功能在MCE时期更为活跃。另外,仅在MCE时期HMGB2的靶基因主要参与脂肪细胞分化和脂类生物合成,而-48h或96h,靶基因涉及在非脂质生成生物过程(图5. d)。 基于755个靶基因,在24h的KEGG分类结果暗示这些靶基因参与脂质代谢、能量代谢和其他重要的生物过程(图5. e)。ChIP-seq结果在24h时期发现了HMGB2的一系列靶基因,包括ATF4、Fos、C/EBPβ等(图5. f)。利用RNA-seq和ChIP-seq数据韦恩图筛选24h基因,下调的差异表达基因与ChIP-seq数据联合分析,仅在24h时期与HMGB2结合的基因共有20个,包括C/EBPβ、Fos、KLF4等。在上调基因中,有19个基因在24h与HMGB2结合,但它们不涉及脂质生成(图5. g)。另外,对hmgb2-/-小鼠和野生型小鼠的腹股沟白色脂肪进行转录组分析,结果说明涉及脂肪生成的关键基因,比如C/EBPβ、C/EBPδ、 PPARγ、 KLF4 和C/EBPα,都在hmgb2-/-小鼠中下调表达。综上所述,HMGB2主要在MCE期起调节脂肪形成的作用。
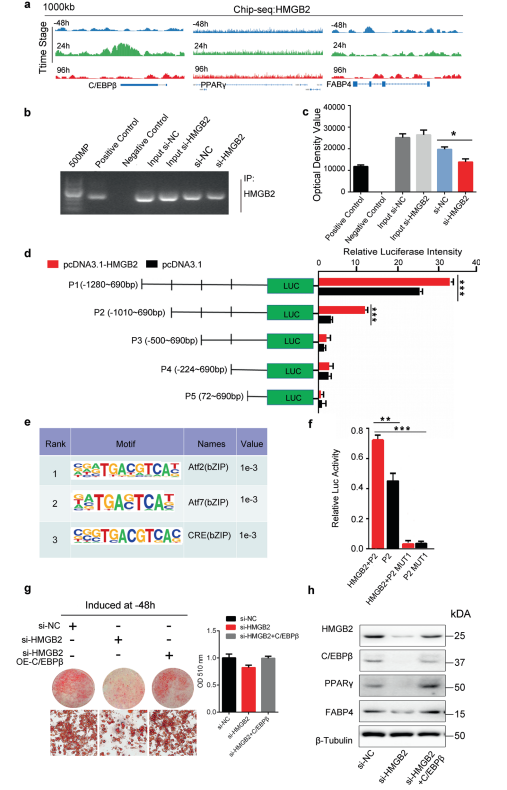
图5. 脂肪生成过程不同时期HMGB2结合靶基因的分析 6. HMGB2结合C/EBPβ启动子促进脂肪形成 考虑到C/EBPβ在MCE时期的重要性,在该研究中它被选作与HMGB2结合的候选基因。ChIP-seq数据显示,HMGB2富集C/EBPβ的峰仅在MCE时期(24h),而不在其他时期,这一结果由分别在-48h、24h和96h时期的HMGB2结合C/EBPβ启动子的染色质峰图证实(图6. a)。同时,在-48h或96h时HMGB2在PPARγ和FABP4上的富集无明显变化。这一结果暗示在MCE时期HMGB2仅结合C/EBPβ的启动子,且不会与终端分化和脂解的关键基因结合。当敲除HMGB2的表达时,HMGB2在 C/EBPβ启动子上的富集明显减少,这一结果由ChIP-qPCR证实(图6. b和c)。 为了筛选能够增强 C/EBPβ转录的HMGB2结合位点,选取C/EBPβ转录起始位点附近2kb区域DNA片段截短,将它们插入pGL3-Basic载体上。构建好的质粒转入293T细胞,荧光强度检测结果表明最强转录活性的结合区域位于C/EBPβ启动子的P1片段(-1280-690bp相对于TSS),其次是P2片段(-1010-690bp);而P3(-500-690bp)、P4(-224-690bp)和P5(72-690bp)片段的荧光强度几乎检测不到(图6. d)。这些结果表明,HMGB2与C/EBPβ结合的有效启动子区域主要位于P1和P2,后者包含3个来自P2和P3之间不同区域与bZIP家族相关的预测结合motif(图6. e)。 当位于C/EBPβ -889bp处的“GGGTCTCAC”位点突变后,即使将HMGB2超表达转录活性也完全丧失了(图6. f),这表明该位点是招募HMGB2促进C/EBPβ转录不可缺少的。另外,它表明si-HMGB2引起的脂质积累减弱可以通过超表达挽救(图6. g),这一点由成脂基因的蛋白水平和油红O染色证实(图6. h)。
图6. HMGB2在MCE时期结合C/EBPβ启动子从而调控脂肪形成 结语总之,该研究发现HMGB2在MCE时期与C/EBPβ启动子结合在调控脂肪形成中发挥重要作用。当敲除HMGB2时,HMGB2与C/EBPβ的互作减弱。由于HMGB2的丢失,C/EBPβ的表达减弱,抑制MCE,导致体内脂肪形成抑制,成熟脂肪细胞变小和身材变小。该研究利用ChIP-seq找到了HMGB2的靶基因C/EBPβ,并验证了他们之间的互作机制,为肥胖提供了潜在的治疗靶点。 |