NEWS
新闻资讯
|
客户文章 | IF=7.561 猪肺泡巨噬细胞组蛋白巴豆酰化组学助力弓形虫感染诱导的免疫机制研究
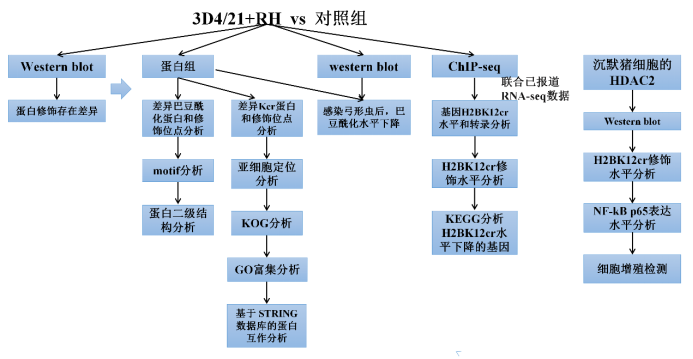
发表单位:华中农业大学动物医学院 发表日期:2021年7月8日 期 刊:Front Immunol(IF: 7.561) 2021年7月8日华中农业大学动物医学院方瑞团队在杂志Front Immunol(IF: 7.561)发表题为“Toxoplasma gondii Infection Inhibits Histone Crotonylation to Regulate Immune Response of Porcine Alveolar Macrophages”的研究论文。该研究利用蛋白组和ChIP-seq对弓形虫感染猪肺泡巨噬细胞的巴豆酰化进行了全面系统的分析,为弓形虫感染诱导的免疫机制研究提供了新见解。爱基百客为该研究提供了ChIP和ChIP-seq的技术支持。
研究背景 刚地弓形虫(Toxoplasma gondii, T. gondii)是一种重要的食源性和水源性人畜共患病病原体,这种专性细胞内寄生虫可以感染所有温血动物。目前研究表明食用未煮熟的感染弓形虫的肉类可能是人类弓形虫病病例的主要来源之一。随着养猪业的发展,弓形虫对公众健康造成了严重影响,防控猪弓形虫感染对预防人类弓形虫病具有重要意义。巨噬细胞作为一种重要的效应细胞,直接参与宿主对原虫感染的防御。赖氨酸巴豆酰化 (Lysine crotonylation, Kcr)是新近发现的一种翻译后修饰,最早发现于组蛋白上,已被证实与生殖调控、转录激活和细胞信号通路有关。然而,在感染刚地弓形虫的巨噬细胞中组蛋白巴豆酰化的生物学功能尚未报道过。 研究材料 猪肺泡巨噬细胞(3D4/21细胞)、PK-15细胞、弓形虫I型株RH△hxgprt研究思路
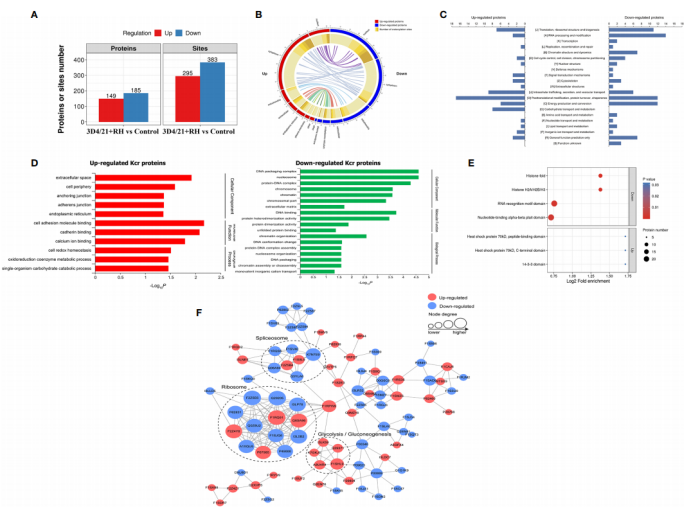
研究结果 1. 猪肺泡巨噬细胞Kcr蛋白质组的全局分析 为了确认感染弓形虫猪肺泡巨噬细胞存在蛋白修饰差异,作者利用抗-巴豆酰基赖氨酸抗体进行Western blot分析(图1. A)。另外,基于免疫亲和富集和高通量LC-MS/MS的蛋白组测序,作者定量分析差异表达的巴豆酰基蛋白和修饰位点(图1. B)。在458个蛋白中鉴定到1557个独特的巴豆酰基位点,在这些位点中414个蛋白的1286个Kcr位点被定量。在这些Kcr蛋白中,192个(46.4%)蛋白有单一的Kcr位点,62个(15%)蛋白有超过6个Kcr位点(图1. C)。 为了探索这些Kcr位点的序列特性并推测其特定的motif,作者利用MoMo软件对所有鉴定的巴豆酰基化蛋白进行富集motif分析。鉴定发现LXXKcrXXXXE、KcrE、AXKcrKcr、KcrXXXDKcr、KcrXXXXXXXKcr、AKcr、 AXXXKcr、 KcrF、KcrD、KcrH、KcrKcr、 KcrXXXXXXXXR, 和KXXXXKcr有不同的丰度(图1. D和E),这些motif与此前报道其他翻译后修饰的Kcr motif不同。 作者随后应用NetSurfP探索赖氨酸巴豆酰化和蛋白二级结构的关系;结构分析反映大约有33.9%的Kcr位点位于α-螺旋,5.5%的Kcr位点发现在β折叠,剩余的60.7%位于无序线圈(图1. F)。考虑到所有蛋白赖氨酸残基和巴豆酰赖氨酸残基之间的分布模式没有明显差异,作者认为感染弓形虫后的3D4/21细胞的Kcr结构没有偏好。同样的,Kcr的表面可及性和全部的蛋白赖氨酸残基也没有明显差异,暗示修饰蛋白残基的表面属性可能没有受到Kcr的影响。
图1. 猪肺泡巨噬细胞Kcr蛋白组的整体分析 2. 感染弓形虫的猪肺泡巨噬细胞中赖氨酸巴豆酰化的定量分析 作者接下来定量分析弓形虫感染后蛋白Kcr的变化,并与3D4/21细胞的总蛋白丰度进行了比较。在3D4/21+RH vs对照组中149个蛋白中295个修饰位点上调,185个蛋白中383个修饰位点下调(图2. A)。可量化蛋白的亚细胞定位分析证明大部分上调修饰蛋白预测在细胞质(52%)和细胞核(16%)中,且11%的蛋白质与线粒体有关。下调蛋白的三种主要亚细胞成分也与细胞核(35%)、细胞质(32%)和线粒体(18%)相关(图2.B)。 在RH+3D4/21 vs 对照组比较分析中,利用NCBI数据库对所有差异修饰蛋白进行KOG分析,结果表明差异修饰蛋白的功能主要集中在翻译后修饰、蛋白质转换、伴侣、翻译、核糖体结构和生物发生、RNA加工和修饰等方面(图2. C)。为了更好地阐明弓形虫感染后3D4/21细胞中赖氨酸巴克酰化的潜在功能和差异修饰蛋白的生物学功能,作者对差异修饰蛋白进行GO富集分析。对于下调的巴克酰化蛋白,重要的生物学过程有染色质组织、DNA构象改变和蛋白质- DNA复合体组装;而大量上调的修饰蛋白参与了细胞氧化还原稳态、氧化还原辅酶代谢过程和单生物碳水化合物分解代谢过程(图2. D)。上述结果表明,Kcr蛋白在弓形虫感染巨噬细胞后的多种生物学过程中发挥了重要作用。在蛋白结构域富集分析中大部分富集蛋白呈现下调,它们是核苷酸结合alpha-beta结构域、RNA识别motif结构域、组蛋白H2A/H2B/H3和组蛋白折叠(图2. E)。蛋白-蛋白相互作用(protein - protein interaction, PPI)分析结果显示大多数核糖体和剪接体相关蛋白的Kcr水平下调,暗示弓形虫感染可能负调控巨噬细胞的Kcr(图2. F)。
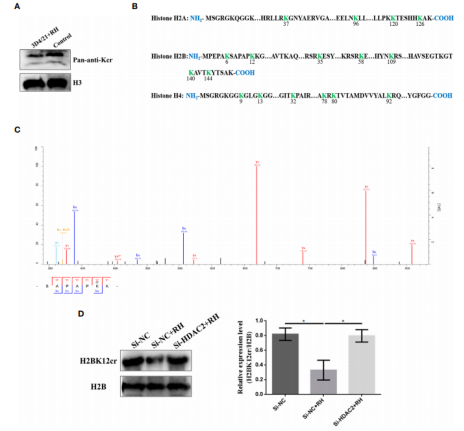
图2. 弓形虫感染后猪肺泡巨噬细胞赖氨酸巴豆酰化的定量分析 3. 弓形虫感染负调控猪肺泡巨噬细胞中组蛋白Kcr 组蛋白PTMs已被证明在许多生物学过程中发挥重要作用,如细胞生长、分化和表观发生。赖氨酸是一种进化保守的组蛋白翻译后修饰标记物,被认为是组蛋白中活性启动子的可靠指标。因此,作者聚焦于组蛋白的赖氨酸巴豆酰化,共鉴定和定量了17个组蛋白Kcr位点。这些鉴定的组蛋白主要分布于组蛋白H2A、H2B、H4,所有鉴定的位点巴豆酰化水平显著下降,这与western bot结果一致(图3. A和B)。然后,作者注意点放在H2BK12cr上,调查弓形虫感染后巨噬细胞组蛋白Kcr的调控效应。LC-MS/MS监测到弓形虫感染后3D4/21细胞内的组蛋白H2BK12cr下降了0.67倍,Western blot的结果进一步证实了H2BK12cr水平的减少(图3. C和D)。以上这些结果证明弓形虫感染负调控猪肺泡巨噬细胞的组蛋白Kcr。
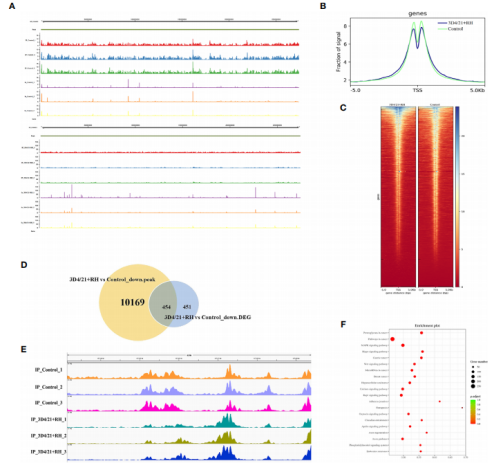
图3. 刚地弓形虫负调控猪肺泡巨噬细胞的组蛋白巴豆酰化 4. 弓形虫感染通过表观修饰抑制H2BK12的巴豆酰化 为了探索H2BK12巴豆酰化的染色质功能,作者对对照细胞和3D4/21+RH细胞进行抗H2BK12cr染色质免疫沉淀测序。从结果上可以看出在三次重复基因组中H2BK12cr得到很好地表征(图4. A),并且H2BK12cr水平在转录起始位点(TSS)达到最高峰(图4. B和C)。为了探索H2BK12cr和转录的关系,作者将chip-seq与以前报道的RNA-seq联合分析。作者发现454个基因的H2BK12cr水平显著下降,与转录水平同步下降(超过50%的基因显著下调),这进一步支持弓形虫感染抑制H2BK12cr巴豆酰化进而抑制基因表达(图4.D)。 为了进一步确认H2BK12cr对弓形虫感染的表观调控,作者观察到在NF-κB抑制剂(NF-κBIZ)外显子区域H2BK12cr修饰水平显著上调,这可能意味着NF-κB的抑制作用(图4. E)。此外,KEGG通路分析显示H2BK12cr水平下调的基因在转录调控和增殖相关通路中显著富集,如MAPK信号通路、Wnt信号通路和Rap1信号通路(图4. F)。
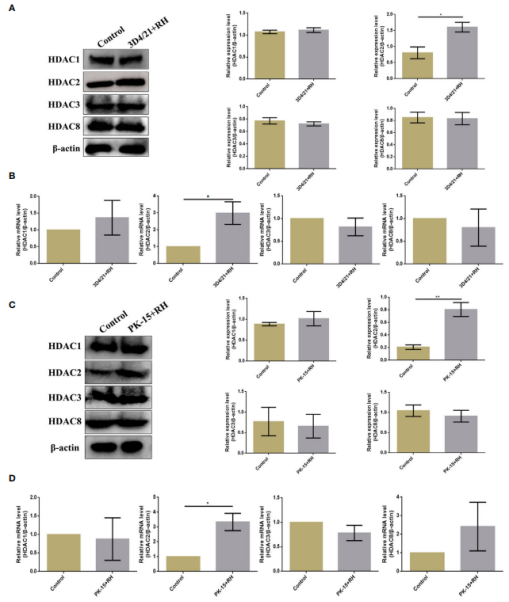
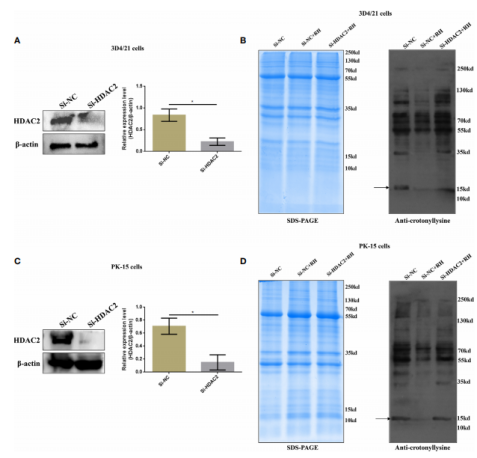
图4. 刚地弓形虫引起猪肺泡巨噬细胞中H2BK12cr减少 5. 刚地弓形虫感染后HDAC2主要调节猪肺泡巨噬细胞内的Kcr水平 HDACs是许多人类疾病的主要表观遗传调节因子。作者检测了几个HDACs(HDAC1、HDAC2、 HDAC3和 HDAC8)的表达水平,只有HDAC2表达水平升高。作者随后确认了感染弓形虫的猪细胞内HDAC2巴豆酰化的调控功能。采用pan-Kcr抗体进行Western blot分析,结果表明沉默HDAC2的猪细胞感染弓形虫后Kcr的水平与未感染的细胞类似(图6),作者进一步观察到沉默HDAC2也能有效恢复H2BK12cr的修饰水平,暗示HDAC2与刚地弓形虫刺激诱导的Kcr的动态变化高度相关(图3. D)。总之,这些数据表明弓形虫感染引起的Kcr修饰水平的降低确实是通过HDAC2介导的,HDAC2可能在弓形虫感染的猪肺泡巨噬细胞的组蛋白去巴豆酰化中发挥重要作用。
图5. 弓形虫导致猪肺泡巨噬细胞和PK-15细胞内的HDAC2减少
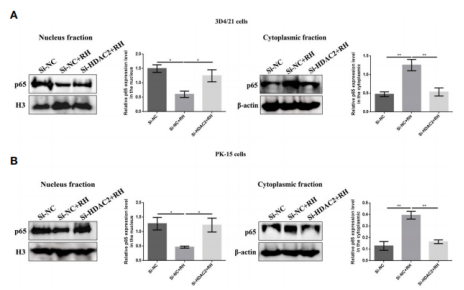
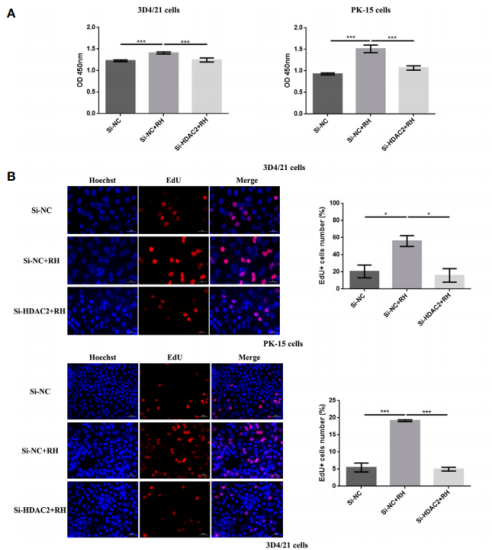
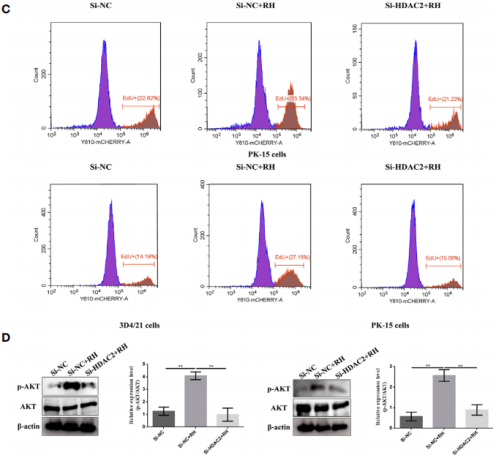
图6. HDAC2对猪肺泡巨噬细胞和PK-15细胞巴克酰化的影响 6. HDAC2调控的组蛋白巴豆酰化抑制NF-κB激活,促进感染弓形虫猪肺泡巨噬细胞增殖 NF-κB是一个二聚体转录因子家族,在寄生虫感染的巨噬细胞调节免疫应答中发挥重要作用。鉴于H2BK12cr在NF-κBIZ的外显子区域显著上调,作者接下来测量了感染弓形虫细胞中NF-κB通路的激活情况。结果表明感染细胞与对照细胞相比,在细胞核提取物中NF-κB p65的表达水平下调,在细胞质中NF-κB-p65的表达水平上调,而HDAC2沉默的细胞感染弓形虫后NF-κB-p65表达水平与未感染细胞一致(图7)。总而言之,这些数据表明由HDAC2调节的组蛋白巴豆酰化抑制转录因子NF-κB的激活。 为进一步调查组蛋白Kcr是否调节巨噬细胞增殖,作者测量了寄生虫感染后的细胞增殖情况。如图8A-C,弓形虫感染后增加了细胞增殖,而HDAC2沉默后中和了这种增加。接下来作者分析了弓形虫感染后哪些信号通路调节巨噬细胞增殖。以往的研究证明激活PI3K/Akt信号通路能够促进细胞增殖,作者的结果反映弓形虫感染导致巨石细胞增殖确实是由PI3K/Akt信号通路信号激活调节的(图8. D)。
图7. HDAC2调控的组蛋白巴豆酰化对NF-κB激活的影响。
图8. HDAC2调控的组蛋白巴豆酰化对感染弓形虫后细胞增殖的影响 结语该研究为感染弓形虫猪肺泡细胞内的组蛋白巴豆酰化的生物学功能提供全面的理解,这份研究首次反映猪肺泡巨噬细胞内巴豆酰化的存在。组蛋白Kcr功能的揭示可以为宿主抗弓形虫免疫应答机制的研究提供一定的研究基础,也可能为寄生虫免疫逃逸机制的研究提供新的思路。 |