NEWS
新闻资讯
|
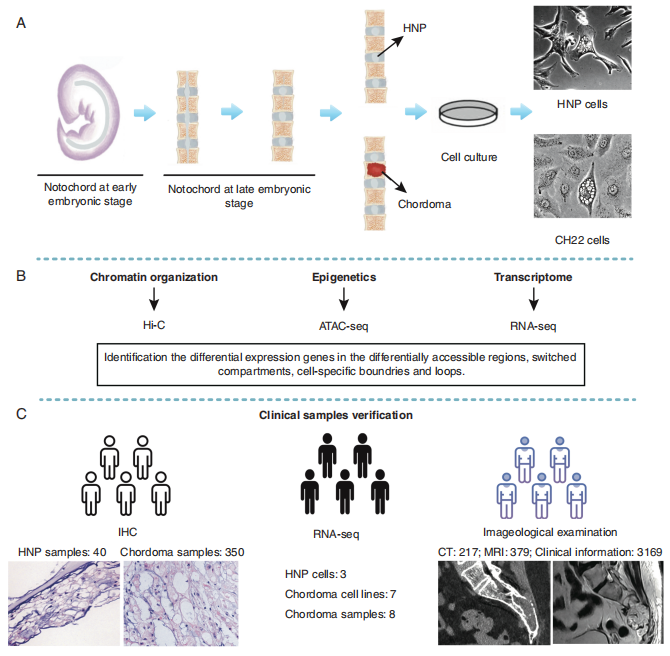
5文IF>10! Hi-C多组学在癌症研究中的进展 | Hi-C专题上期Hi-C专题《多篇IF 10分+带你了解Hi-C在植物方向的研究成果(近2年) | Hi-C专题》介绍了Hi-C在植物方向的应用,本期小编精选了5篇癌症方向(脊髓瘤、膀胱癌、乳腺癌、儿童脑癌和白血病)的高分文章,希望继续帮大家开阔思路。 01 Hi-C与脊髓瘤 一个比较综合多组学分析确定CA2作为脊索瘤的一个新靶点 2021年10月1日上海交通大学医学院在期刊Neuro Oncol(IF: 12.3)发表题为“A comparative integrated multi-omics analysis identifies CA2 as a novel target for chordoma”的研究论文。该研究利用Hi-C多组学技术分析了脊索瘤细胞和人髓核细胞,发现了一个碳酸酐酶II CA2,靶向CA2的抑制剂能够抑制脊索瘤细胞增殖、转移、致瘤性和破骨细胞分化。
文章标题:A comparative integrated multi-omics analysis identifies CA2 as a novel target for chordoma 发表时间:2021年10月1日 发表期刊:Neuro Oncol(IF: 12.3) 技 术:Hi-C、ATAC-seq、RNA-seq(爱基百客均可提供) 研究材料:脊索瘤细胞系CH22、人髓核细胞 摘 要 脊索瘤是一种罕见的间充质恶性肿瘤,复发率高,肿瘤发生机制不明确。遗传改变、表观遗传调控和染色质空间组织在脊索瘤的发生和发展中起着至关重要的作用。该研究整合多组学(Hi-C、ATAC-seq和RNA-seq)综合分析揭示脊索瘤的新的治疗靶点。
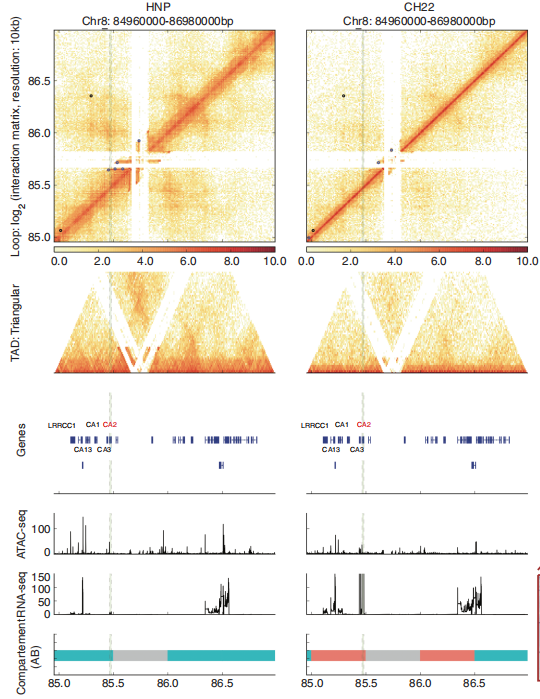
研究方案 该研究发现骨微环境在脊髓瘤发生中扮演重要角色。通过比较染色质多层级结构,在转换的区室、细胞特异边界和loops里鉴定得到CA2(碳酸酐酶II)和THNSL2(苏氨酸合酶类 2)。此外,CA2在脊髓瘤中高表达但在HNP中很少发现。通过基因缺失或药物Dorzolamide HC治疗抑制CA2,可显著抑制脊索瘤细胞的生长和转移。此外,Dorzolamide HCl还通过阻断骨髓单核细胞破骨细胞分化调控骨微环境。总之,该研究揭示了骨微环境在脊索瘤发生中的作用,并确定CA2作为脊索瘤的一个新的治疗靶点;研究结果还表明盐酸多唑胺是治疗脊索瘤的一种有前途的选择。
HNP和CH22之间基因组CA2区域的转录组、表观遗传学和三维层次结构的差异。 小结:Hi-C联合其他组学综合分析找到脊髓瘤新的治疗靶点。 02 Hi-C与膀胱癌 膀胱癌亚型有关的表观景观和3D基因组结构 2021年4月15日,美国西北大学范伯格医学院与宾夕法尼亚州立大学医学院团队联合在杂志Genome Biol(IF: 13.583)发表题为“Subtype-associated epigenomic landscape and 3D genome structure in bladder Cancer”的研究论文。该研究利用Hi-C与其他组学技术分析了膀胱癌的表观和3D基因组特征,并发现了一个转录因子NPAS2与临床膀胱癌亚型之间的一种新的联系。
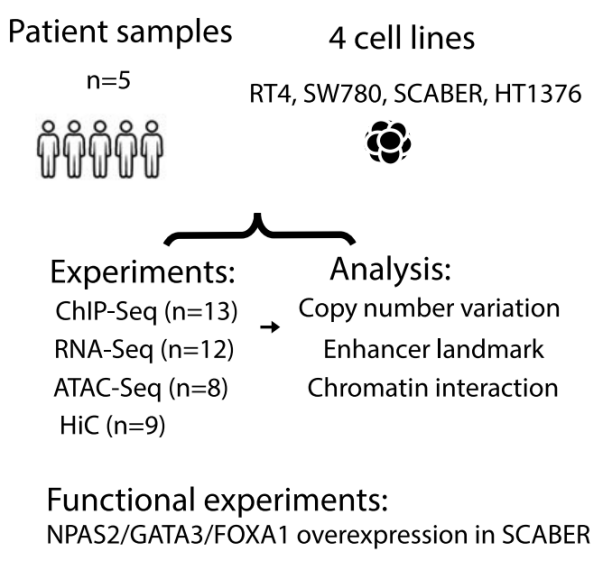
文章标题:Subtype-associated epigenomic landscape and 3D genome structure in bladder Cancer 发表时间:2021年4月15日 发表期刊:Genome Biol(IF: 13.583) 技 术:Hi-C、ATAC-seq、RNA-seq、ChIP-Seq(爱基百客均可提供) 研究材料:膀胱癌细胞系RT4、SCABER、SW780和 HT1376;膀胱肿瘤样本 摘 要 肌肉浸润性膀胱癌以腔内和基底基因不同的表达为特征,可用于预测疾病进程和总生存率等关键临床特征。FOXA1、GATA和PPARG被证明是腔体亚型特异性基因调控和亚型切换所必需的,而TP63、STAT3和TFAP2家族成员是调控基底亚型特异基因的关键。尽管已有这些研究进展,但膀胱癌亚型特异性调控的潜在表观遗传学机制和3D染色质结构仍不清楚。 作者确定了膀胱癌腔内亚型和基底亚型的全基因组转录组、增强子景观以及FOXA1和GATA3的转录因子结合图谱。作者首次报道了膀胱癌细胞系和原发性患者肿瘤中Hi-C染色质互作图谱。作者还发现亚型特异转录伴随着特异性的开放染色质和表观组标记,至少部分受腔内和基底膀胱癌远端增强子的特异转录因子结合所驱动。最后,作者鉴定到一个新的临床相关转录因子,NPAS2,在管腔型膀胱癌中调节其他亚型特异性基因并影响癌细胞增殖和转移。总之,该研究发现了腔内和基底膀胱癌中独特的表观基因组特征和3D基因组结构,并提示了昼夜节律转录因子NPAS2与临床膀胱癌亚型之间的一种新的联系。
研究方案 小结:利用Hi-C与其他组学技术探索了膀胱癌的表观特征和3D基因组结构,发现了一个转录因子调控膀胱癌增殖和转移。 03 Hi-C与乳腺癌 三阴性乳腺癌三维染色质结构的比较特征 2022年5月5日,韩国科学技术高级研究院联合首尔大学医学院在期刊Exp Mol Med(IF: 12.153)发表题为“Comparative characterization of 3D chromatin organizationin triple-negative breast cancers”的研究论文。该研究以三阴乳腺癌为研究对象,利用Hi-C与其他组学对正常和乳腺癌的细胞系和组织进行了3D基因组结构的比较分析,将染色质的破坏结构与各种表观遗传特征和转录组关联。
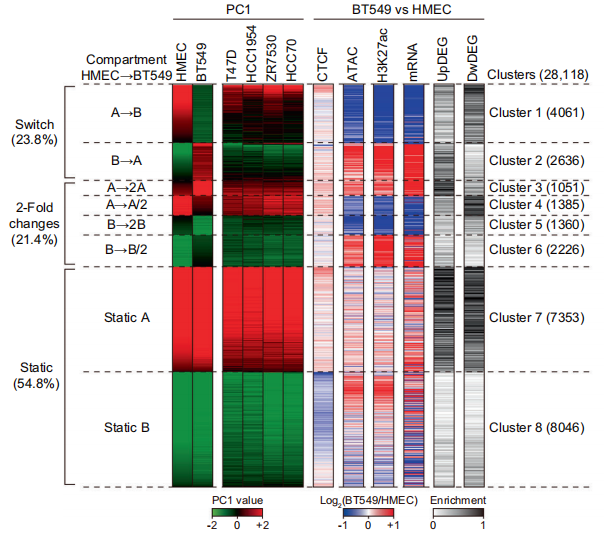
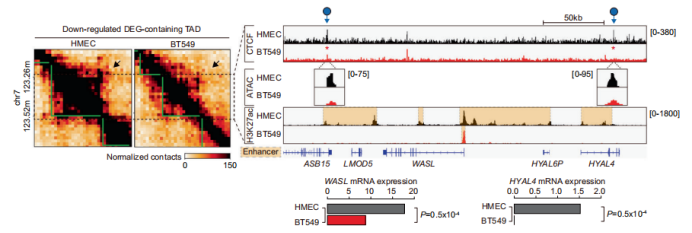
文章标题:Comparative characterization of 3D chromatin organizationin triple-negative breast cancers 发表时间:2022年5月5日 发表期刊:Exp Mol Med(IF: 12.153) 技 术:Hi-C、ATAC-seq、ChIP-seq和RNA-seq(爱基百客均可提供) 研究材料:乳腺癌细胞系、乳腺癌组织 摘 要 三阴性乳腺癌(Triple-negative breast cancer, TNBC)是一种恶性肿瘤亚型,与其他乳腺癌亚型相比,具有较高的复发风险和侵袭性表型。虽然目前许多乳腺癌研究都研究了遗传变异和不同的靶基因表达,但TNBC中三维染色质结构是如何重组的还不清楚。在这个研究中,作者使用原位Hi-C技术,与正常细胞相比,分析了代表五种不同亚型乳腺癌(包括TNBC)的细胞中的3D染色质组织。 作者发现乳腺癌的全局和局部的3D结构被严重破坏。与正常细胞相比,TNBC细胞系(尤其是BT549细胞)的变化最为显著。作者检测到CTCF依赖的TNBC敏感的缺失和重复的3D染色质组织,并发现这些变化与染色质可及性紊乱和转录失调密切相关。与正常组织相比,TNBC组织的3D染色质也出现了紊乱。作者观察到TNBC细胞中被扰动的局部3D结构在TNBC组织中部分保存下来。最后,通过比较正常和TNBC组织,作者发现了不同的组织特异性染色质环。在本研究中,作者阐明了乳腺癌中相对于正常细胞/组织的3D染色质组织在多个尺度上的特征,并确定了破坏结构与各种表观遗传特征和转录组之间的关联。总之,该研究结果为未来TNBC的诊断和治疗研究提供了重要的3D染色质结构特征。
多组学联合分析 小结:Hi-C与其他组学联合分析乳腺癌细胞和组织,从不同层次的结构分析乳腺癌与正常细胞/组织的差异。 04 Hi-C与儿童高级胶质瘤 儿科高级别胶质瘤的表观基因组景观和三维基因组结构 2021年6月2日,西北大学范伯格医学院的研究团队在期刊Sci Adv(IF: 14.136)发表题为“Epigenomic landscape and 3D genome structure in pediatric high-grade glioma”的研究论文。该研究首次全面分析了儿童高级别胶质瘤(pHGG)3D基因组特征,并发现3D结构的改变可能促进肿瘤的生成。
文章标题:Epigenomic landscape and 3D genome structure in pediatric high-grade glioma 发表时间:2021年6月2日 发表期刊:Sci Adv(IF: 14.136) 技 术:Hi-C、ATAC-seq、RNA-seq、ChIP-Seq(爱基百客均可提供) 研究材料:H3K27M DIPG细胞、H3K27 野生型GBM细胞、神经干细胞、正常人的星形胶质细胞;DIPG癌组织和正常额叶皮层组织 摘 要 小儿高级别胶质瘤(pHGG)是一种高发病率的脑肿瘤,尽管经过治疗,但5年生存率低于20%。pHGG是儿童最常见的恶性脑肿瘤,是儿童癌症相关死亡的最大原因。儿童高级别胶质瘤,包括多形胶质母细胞瘤(GBM)和弥漫性固有脑桥胶质瘤(DIPG),是病态的脑瘤。高达80%的弥漫性固有脑桥胶质瘤在组蛋白H3编码基因中存在体细胞错义突变。 为了研究H3K27M是否与改变转录调控的不同染色质结构有关,作者首次生成了pHGG细胞系和癌症组织的高分辨率Hi-C图谱。联合H3K27M和野生型样本的转录组、增强子景观(ChIP-seq)、Hi-C和染色质可及性(ATAC-seq)数据,作者鉴定到癌症特异增强子和已知癌基因的调控网络。作者还确定了导致潜在增强子劫持和基因共扩增的基因组结构变异,包括A2M、JAG和FLRT1。总之,结果表明三维基因组改变可能在pHGG表观遗传景观中发挥关键作用,并促进肿瘤的发生。 小结:利用Hi-C与其他组学技术联合分析3D基因组结构改变对表观调控的影响,进而分析对pHGG癌症的影响。 05 Hi-C与淋巴细胞白血病 T细胞急性淋巴细胞白血病的三维染色质景观 2020年4月2日,纽约大学医学院团队在顶级期刊Nat Genet(IF: 38.33)发表题为“Three-dimensional chromatin landscapes in T cell acute lymphoblastic leukemia”的研究论文。该研究结合利用原位Hi-C、RNA-seq和CTCF-ChIP-seq数据集,通过研究三维染色质结构来探讨染色质结构对人类急性白血病的影响。
文章标题:Three-dimensional chromatin landscapes in T cell acute lymphoblastic leukemia 发表时间:2020年4月2日 发表期刊:Nat Genet(IF: 38.33) 技 术:Hi-C、ATAC-seq、RNA-seq、ChIP-Seq等(爱基百客均可提供) 研究材料:CUTLL1和Jurkat细胞系,原发淋巴细胞白血病病人样本 摘 要 三维(3D)染色质结构差异可以影响拓扑关联结构域(TADs)的完整性,并重新连接特异性增强子-启动子相互作用,影响基因表达并导致人类疾病。在该研究中,使用初始人类白血病标本作者研究了T细胞急性淋巴细胞白血病(T- all)的三维染色质结构及其对药物的动态反应。系统整合了原位Hi-C、RNA-seq和CTCF ChIP-seq数据集,结果反映T细胞急性淋巴细胞白血病的内部TAD染色质互作和TAD边界绝缘存在广泛的差异。作者鉴定和聚焦于与CTCF介导的绝缘有关的一个TAD“融合”事件,使MYC启动子和远端超级增强子直接相互作用成为可能。此外,数据还表明靶向致癌信号转导或表观遗传调控的小分子抑制剂可以改变白血病中特定3D相互作用。总而言之,这份研究强调了3D染色质结构在人类急性白血病中的影响、复杂性和动态性。 小结:综合Hi-C多组学联合分析3D染色质结构对人类白血病的影响,为解释疾病的发生和调控带来更深的理解,并可能提供了一些潜在治疗靶点。 除了本期推文里提到过的几种癌症,之前的推文里有篇文献解读《文献解读|以Hi-C数据为核心,结合表观组学探究胰腺癌转移机制》,也是Hi-C技术在癌症研究中的应用,该研究报道了胰腺癌转移中最全面的3D表观基因组研究,并确定了促进胰腺癌转移的候选基因。 总结,Hi-C技术在癌症中的应用策略主要是联合其他组学技术,如ATAC-seq、ChIP-seq和RNA-seq,用来探索癌症的表观景观和3D基因组结构特征。将多组学的数据联合起来分析,在不同3D层次结构里将结构差异与基因表达变化、表观修饰变化等相关联起来,这个策略在揭示肿瘤发生机制、靶标分子等上具有重要价值。 文献参考 1. Meng T, Huang RZ, Jin JL, et al. A comparative integrated multi-omics analysis identifies CA2 as a novel target for chordoma. Neuro Oncol. 2021. 23: 1709-1722. DOI: 10.1093/neuonc/noab156. 2. Iyyanki T, Zhang B, Wang Q, et al. Subtype-associated epigenomic landscape and 3D genome structure in bladder cancer. Genome Biol. 2021.22:105. doi: 10.1186/s13059-021-02325-y. 3. Kim T, Han S, Chun YJ, et al. Comparative characterization of 3D chromatin organization in triple-negative breast cancers. Exp Mol Med. 2022. 54: 585-600. DOI: 10.1038/s12276-022-00768-2. 4. Wang J, Huang TYT, Hou Y, et al. Epigenomic landscape and 3D genome structure in pediatric high-grade glioma. Sci Adv. 2021. 7: eabg4126. DOI: 10.1126/sciadv.abg4126. 5. Kloetgen A, Thandapani P, Ntziachristos P, et al. Three-dimensional chromatin landscapes in T cell acute lymphoblastic leukemia. Nat Genet. 2020. 52: 388-400.DOI: 10.1038/s41588-020-0602-9. 往期推荐: |