NEWS
新闻资讯
|
客户文章 | PLOS Biology浙江大学发现调控罗伯茨绿僵菌响应昆虫体壁和血腔两个微环境的新调控通路
期刊:PLOS Biology 影响因子:9.593 发表日期:2021.8.4 单位:浙江大学 2021年8月4日浙江大学生命科学学院微生物研究所生物系统稳态与保护教育部重点实验室方卫国教授团队在PLOS Biology上发表一篇名为“A novel cascade allows Metarhizium robertsii to distinguish cuticle and hemocoel microenvironments during infection of insects”的研究论文。作者在该研究中报道了一种新的级联反应,该级联反应在昆虫发病过程中调节罗伯茨绿僵菌对两个不同的微环境的反应。转录因子COH2主要在昆虫角质层中发挥作用,它可以激活角质层穿透基因的表达,而与COH2互作的调控蛋白COH1可以在血液腔定植期间高表达。作者通过基因组、转录组、ChIP-seq等多组学联合分析阐述了 COH1 与 COH2 之间的相互作用结果,该研究有助于推进我们对昆虫真菌致病性的认识。爱基百客为该研究提供ChIP-seq的技术支持。
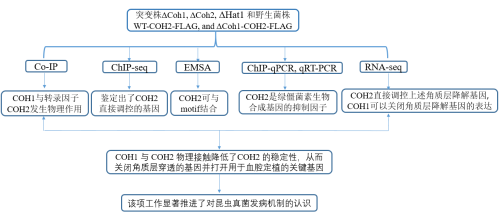
01 研究背景 昆虫、植物和哺乳动物的真菌病原体在感染宿主时通常会遇到动态的微环境,但它们对微环境的响应和适应机制尚不清楚。罗伯茨绿僵菌(Metarhizium robertsii)作为研究真菌感染昆虫的一个模式菌,它在感染昆虫的过程中,会遇到了两种不同的微环境:昆虫角质层和昆虫血腔。昆虫角质层是抵御真菌侵染的第一屏障,罗伯茨绿僵菌突破这一屏障的机制与一些植物病原真菌类似,会形成附着感染机制。而在昆虫血腔中,它抵御寄主免疫的机制与人类病原真菌的类似。此外,绿僵菌种作为一种绿色环保的杀虫剂可应用在农业害虫和病媒的生物防治中。因此,详细了解的真菌致病性机理知识,有助于真菌杀虫剂的开发和改进。 02 研究思路
03 研究材料 研究材料:罗伯茨绿僵菌基因缺失突变体 04 研究结果 01 Coh1基因的表达与调控
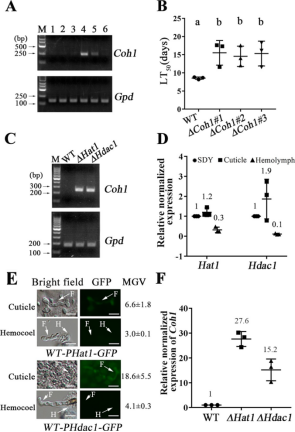
图1 Coh1基因的表达与调控 Coh1基因:参与血液腔定植,在血液腔定植期间高表达。为了研究Coh1的生物学功能,作者构建了一个缺失突变体(ΔCoh1),该突变体删除了整个ORF。用致死时间(LT50)测定大蜡螟幼虫的致病性。用两种方式将缺失突变体(ΔCoh1)接种到昆虫体内(一种是直接将分生孢子涂在昆虫角质层上,另一种是将分生孢子注射到昆虫的血液腔内(绕过角质层))。结果表明,3株突变株ΔCoh1的LT50值比野生株高约2倍(图1B)。作者还发现 Coh1 在 11 个表观遗传突变体中表达,组蛋白乙酰转移酶、去乙酰化酶和甲基转移酶缺失,这个结果表明了这些表观遗传调节因子在腐生生长过程中抑制了Coh1 表达(图1C)。在替代血腔定植期间,突变体ΔHat1中的Coh1表达水平增加了27.6倍,突变体ΔHdac1中的COH1表达水平增加了15.2倍(图1F)。由此,作者推测,在血腔定植过程中,Hat1和Hdac1表达的降低解除了它们对Coh1的负调控,从而导致Coh1的表达,这表明COH1的原始染色体位置对其转录调控至关重要。 02 组蛋白去乙酰化酶和组蛋白乙酰转移酶对Coh1的调控
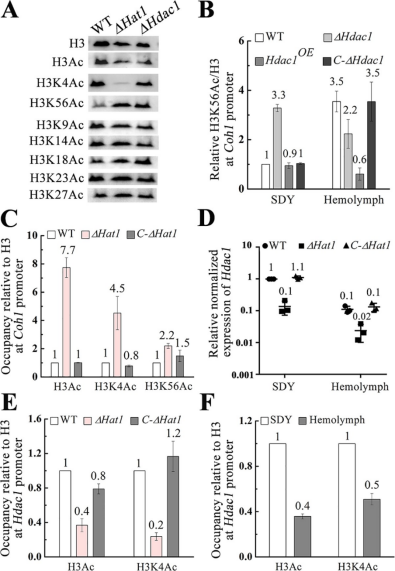
图2 Hat1和Hdac1通过调控启动子区组蛋白H3乙酰化来控制Coh1的表达 为了验证上述推测,作者尝试通过免疫印迹分析组蛋白H3中7个赖氨酸残基的乙酰化水平来确定Hat1和Hdac1的靶位点。结果表明,与野生型菌株相比,突变体ΔHat1中赖氨酸4 (H3K4)上的组蛋白H3乙酰化水平显著降低,而缺失突变体ΔHdac1和ΔHat1中赖氨酸56 (H3K56)上的组蛋白H3乙酰化水平升高(图2A)。Coh1启动子中组蛋白H3、H3K4和H3K56的乙酰化水平在WT株中均低于突变株ΔHat1 (图2C)。此外, ChIP-qPCR分析显示,突变株ΔHat1中Hdac1启动子中组蛋白H3和H3K4的乙酰化水平均低于野生株(图2E)。在野生型菌株中,腐生生长期间Hdac1启动子区组蛋白H3和H3K4的乙酰化水平显著高于替代性血液腔定植期间(图2F)。综上所述,Hat1和Hdac1通过调控启动子区组蛋白H3乙酰化来控制Coh1的表达。 03 Coh1和Coh2相互作用降低了Coh2的稳定性
图3 COH1与转录因子COH2发生物理作用,降低COH2的稳定性 作为调控蛋白,COH1更有可能与其他调控因子相互作用来控制基因表达。首先,作者进行了酵母双杂交实验,结果表明,COH1与1个转录因子(MAA_07838)(图3A)相互作用,该转录因子被称COH2,它参与调节血液的定植。然后,作者研究了COH1和COH2之间的物理相互作用对转录因子COH2活性的影响。为此,作者进行了免疫共沉淀技术,结果证实COH1在体内与COH2发生物理相互作用(图3B)。并且COH1 和COH2 之间的相互作用诱导蛋白酶体降解COH2::FLAG 蛋白(图3E),降低COH2的稳定性。 04 COH1和COH2相互作用可解除COH2介导的对血腔定植基因的抑制
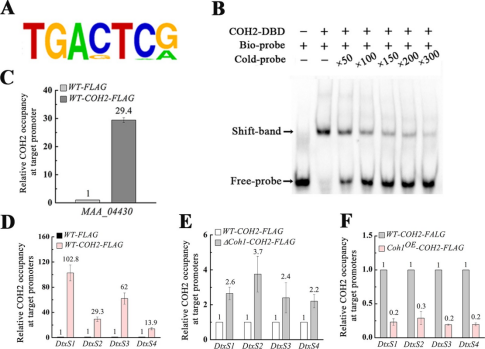
图4 COH1和COH2调控的血液腔定植基因的鉴定 为了探究转录因子COH2是如何通过调控蛋白COH1来调控致病基因的,作者首先对菌株WT-COH2-FLAG进行ChIP-Seq分析,鉴定出了COH2直接调控的基因。在ChIP-Seq分析中共识别出562个由COH2结合的峰值,其中66.4%包含一个共同的7核苷酸基序(TGA[C/G]T[C/A][G/A])(图4A)。凝胶位移试验显示,含有COH2-BM(生物素标记)基序的DNA探针与重组COH2-DBD蛋白结合(图4b)。特定的竞争对手(未标记DNA探针)几乎完全消除了DNA带移(图4B)。ChIP-qPCR分析显示,菌株WT-COH2-FLAG的DtxS1、DtxS2、DtxS3和DtxS4启动子的COH2占用率分别比菌株WT-FLAG高102.8-、29.3-、62.0-和13.9-倍(图4D)。根据qRT-PCR 和ChIP-qPCR结果,作者推测COH2是绿僵菌素生物合成基因的抑制因子,当真菌进入昆虫血腔时,这种抑制作用可以被COH1所缓解。为此,作者构建了一个菌株(ΔCoh1-COH2-FLAG),其融合蛋白COH2::FLAG在突变体ΔCoh1中表达,经过实验证明了COH1可以缓解COH2的抑制作用。 05 COH1抑制血腔定植过程中角质层降解基因的表达
图5 COH1使COH2介导的角质层降解基因在血液腔定植过程中失活 如前所述,除了与调节因子一起调节血腔定植外COH1, COH2也控制着角质层的穿透。作者通过RNA-Seq比较了突变株ΔCOH2和野生株在大蜡螟幼虫上生长时的转录组,证实了COH2直接调控上述角质层降解基因。以MAA_10199和MAA_10350两种蛋白酶和几丁质酶MAA_10456作为COH2在渗透角质层过程中调控的角质层降解基因的代表,3种角质层降解基因在代血腔定殖过程中的表达水平均显著降低(图5C)。在替代血腔定植期间,突变体ΔCoh1中这3种角质层降解基因的表达水平高于野生型菌株(图5E), ΔCoh1中COH2与它们启动子的体内结合也高于野生型菌株(图5F),这些结果说明了Coh1抑制血腔定植过程中角质层降解基因的表达。 05 研究结论 综上所述,作者发现了一个新的调控通路,它可精确控制罗伯茨绿僵菌在昆虫发病过程中对2个独特微环境(角质层和血液腔)的反应。该级联反应包含4个成分:组蛋白 3 乙酰转移酶 HAT1、组蛋白 3 去乙酰化酶 HDAC1、转录因子 COH2 及其相互作用蛋白 COH1。在昆虫角质层上,COH2 开启了角质层穿透的关键基因。一旦真菌到达血腔,2个表观遗传调节因子 HAT1 和 HDAC1 的表达就会降低,这会增加 COH1 启动子中组蛋白 H3 的乙酰化水平,从而激活其表达。COH1 与 COH2 物理接触降低了COH2 的稳定性,从而关闭角质层穿透的基因并打开用于血腔定植的关键基因,该项工作显著推进了对昆虫真菌发病机制的认识。 |