NEWS
新闻资讯
|
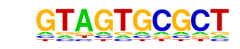
ChIP专题 | 如何进行ChIP-qPCR富集验证 染色质免疫共沉淀技术(Chromatin Immunoprecipitation,ChIP)是一种适用于在体内研究蛋白质与DNA相互作用的方法。这项技术能够帮助研究者判断在细胞核中基因组的某一特定位置会出现何种组蛋白修饰或转录因子结合。目前也是众多学者研究蛋白-DNA互作的主流技术。 许多老师在做完ChIP-seq分析后,通常会找到感兴趣的TF/组蛋白修饰的1个或多个靶基因。为了进一步证实TF/组蛋白修饰与靶基因的结合状态,需要通过不同的技术进行验证。ChIP-qPCR因其体内富集(相比体外实验)能够更真实地反映结合状态的特性,被众多老师青睐。 目前ChIP有两种定量方式,分别为“双△CT法”以及“双标准曲线法”。其中“双标准曲线法”每次实验都必须对目的基因和看家基因做两组标准曲线,并且如果用于做标准曲线的标准品不同于样品,比如标准品为质粒或纯化的PCR产物,而待测样品为富集产物,那么标准曲线的扩增效率并不能真实地反映样品的扩增情况,存在一定误差。因此“双△CT法”成为主要分析的手段。 双△CT法简单介绍 双△CT法也称为2-△△CT法,将PCR的数据转换成CT值(即qPCR反应荧光信号首次到达设定的荧光阈值时所经历的循环数),计算时利用Input做对照(片段化之后直接解交联纯化的DNA,作为材料本身背景)均一化IP产物(△CT),针对阴性抗体富集产物IgG,同样利用Input均一化产物(△CT)。最后计算IP与IgG均一化之后扩增循环数差异(△△CT),并通过2-△△CT计算富集倍数。 实验流程 一、ChIP富集实验 ChIP-qPCR的富集实验与ChIP-seq实验一致。 1、首先是利用1%的甲醛对样本进行交联,以固定蛋白-DNA的结合状态; 2、随后对染色质进行提取和片段化(超声打断或酶切),此时取出一部分染色质(一般是2%Input),对DNA进行纯化,即为Input; 3、对部分染色质进行目标蛋白抗体的孵育与磁珠富集,解交联后纯化DNA,即为IP;同时,另一部分染色质进行IgG抗体的富集,为IgG样本。 4、对Input、IP进行建库和测序可进行ChIP-seq分析,设计引物进行qPCR则为ChIP-qPCR实验。 二、引物设计 2-△△CT法计算原理会假设目标基因在不同的富集产物中的PCR效率基本相似,且ChIP在富集时会对DNA进行打断,因此在引物设计时,产物的长度不宜太长,通常150bp附近最佳。 对于富集类实验,老师可以根据前期seq的结果预测的motif对应的peak两端序列进行引物设计(1),或者利用可视化的软件(如IGV)对peak最明确的位置对应的序列进行引物设计(2)。若前期未进行seq实验,也可利用一些ChIP数据库(如Cistrome DB)查看其他学者是否有进行对应蛋白的ChIP实验,利用别人的结果进行验证(3)。此外,若研究的物种为一些常规物种(如人、鼠),也可利用Jaspar这类转录因子结合位点收纳数据库寻找到转录因子的结合位点,随后在感兴趣的靶基因序列中寻找是否有对应结合区域(4)。 悄悄说一句,在2019年国外的学者开发了一个网页叫ChIPprimersDB,旨在收纳用于ChIP的经过验证的qPCR引物并作为公共存储库,但这个数据库目前还不完善,有感兴趣的老师也可以去关注一波哟~(网址附上:https://dblp.unitrier.de/rec/journals/nar/KurtenbachRH19.html) 引物设计示例: (1)利用FIMO对motif与peak进行序列扫描与对应 Motif: Peak序列: gcctgtagtcccagctactcgggaggctgagacaggaggatcgctTGAGTCCAGGAGTTCTGGGCTGTAGTGCGCTATGCCGATCGGGTGTCCGCACTAAGTTCGGCATCAATATGGTGACCTCCCGGGAGCGGGGGACCACCAGGTTGCCTAAGGAGGGGTGAACCGGCCCAGGTCGGAAACGGAGCAGGTCAAAACTCCCGTGCTGATCAGTAGTGGGATCGCGCCTGTGAATAGCCACTGCactccagcctgggc FIMO匹配结果:
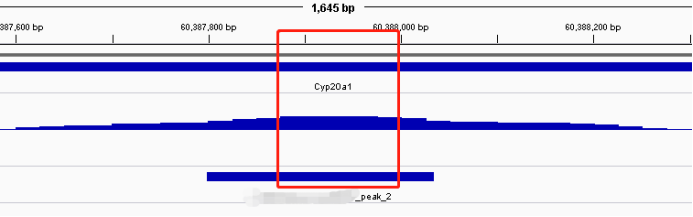
(2)IGV可视化挑选富集区域案例
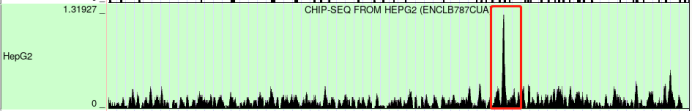
(3)Cistrome DB寻找ATM(TF)的靶基因CHKA
(4)Jaspar寻找HSF1的结合位点
此外,引物设计还需满足一些常规的原则如引物长度、Tm退火温度,GC含量等等。像爱基百客的实验室小伙伴们在进行引物设计(primer5.0)时,通常标准会选择为:引物长度24个核苷酸,最佳Tm值为60°C,GC含量约为50%,扩增片段长度80-160bp,以满足后期PCR需求。 老师们也可以提供具体的序列位置信息委托我们进行引物设计~ 引物设计完成之后,还需要对引物的特异性进行验证,例如oligo7、Primer-Blast、PCR产物琼脂糖凝胶电泳等,防止非特异性扩增对数据分析的干扰(做完qPCR后也可通过溶解曲线是否单一来判断)。 qPCR数据分析 在完成IP实验以及引物设计合成后,就可以进行qPCR实验啦。对每个样本(单个样本通常需要做3个技术重复)的Input、IP、IgG-DNA进行qPCR实验,统计每个复孔的CT值,随后利用2-△△CT法进行富集倍率的计算。 计算公式如下: ΔCt [normalized ChIP] = (Ct [ChIP] - (Ct [Input] -Log2 (Input Dilution Factor)) Input Dilution Factor(IDF)= (fraction of the Input chromatin saved) -1 ΔΔCt [ChIP/NIS] = ΔCt [normalized ChIP] - ΔCt [ IgG ] %Input=2 ^ (CtInput-CtChIP)×IDF×100% (1) Fold Enrichment = 2^ (-ΔΔCt [ChIP/NIS]) (2) 在这个公式中,会涉及到2种常用的标准化ChIP-qPCR数据方法——Percent Input(% Input)法和富集倍率(Fold Enrichment)法。而两种方法的计算都会涉及到一个IDF值,也就是Input稀释因子信息。由于IP以及IgG在qPCR之前需要先经过抗体的富集,而受抗体富集效率、转录因子结合特定等影响,富集产物浓度一般相比Input会较低,为了保证qPCR效率,IP/IgG的加入体积会比Input多,为了保证后续分析的均一性,需要通过IDF值对整体体系进行一个体积的均一化。 1、Percent Input(% Input)法 使用这种方法,通常关注两组不同样本(例如处理前后、发育前后阶段等)Input%是否有差异,从而比较该位点在不同样本间是否存在富集效率的高低。
(不同样本、不同基因的Input%柱状图展示;Kobayashi, E. H. et al.2016) 2、富集倍率(Fold Enrichment)法 这个方法加入了IgG的信息,IgG理论上是不能特异性富集任何的DNA片段,那么,在富集以及后续对富集倍率的计算中,IgG的CT值就可以充当阴性对照与IP进行比较,从而计算富集倍率,因此也能够用于单组单基因的富集验证了。这个值越大,表明富集越明显。 通常来讲,我们会将Fold Enrichment=2作为筛选阈值,理论上富集倍率超过2就认为有富集(但实际上,如果富集倍率超过2但很接近2,例如2.04、2.36这种,是否有富集其实也是见仁见智的,最好还是使用额外的验证技术,比如利用EMSA、双荧光素酶等实验进行辅助验证)。富集倍率法对于样本设计以及位点个数等没有过多要求,因此也是爱基现在主要采用的方案。
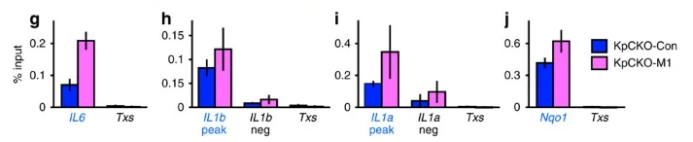
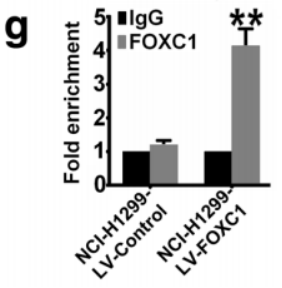
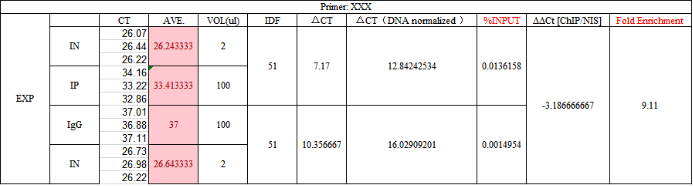
(不同样本、不同基因的FC柱状图展示;Cao S. et al.2018) 数值计算案例:(图中数字无实际项目意义,仅作为模板进行展示)
题外话: 很多老师都会问我们,ChIP-qPCR需要做生物学重复吗? 通常来讲,做3个生物学重复更好,在分析的时候也会具有生物学的统计学意义。因此在条件允许的情况下,我们还是建议老师做生物学重复哦~ 写在最后 至此,有关ChIP qPCR验证实验就介绍到这里啦,爱基百客从2014年成立就开始为各位老师进行表观组学的服务,ChIP富集实验也是我的王牌产品之一,拥有丰富的经验,那么对于ChIP-qPCR当然也不在话下,欢迎各位老师前来咨询。ChIP-seq正在做优惠活动,搭配ChIP-qPCR更好哦。 |