NEWS
新闻资讯
|
项目文章 | ChIP-seq揭示Set2家族通过H3K36甲基化调控病原真菌黄曲霉的真菌毒素代谢和毒力
发表单位:福建农林大学生命科学学院 发表期刊:Virulence(5.428) 发表时间:2022年8月9日 2022年8月9日,福建农林大学生命科学学院汪世华教授团队在期刊Virulence(5.428)发表题为“Set2 family regulates mycotoxin metabolism and virulence via H3K36 methylation in pathogenic fungus Aspergillus flavus”的研究论文。该研究利用ChIP-seq分析,提出通过H3K36三甲基化,Set2甲基转移酶家族利用转录水平和底物利用水平控制真菌毒素的代谢。爱基百客为该研究提供ChIP-seq和ChIP-qPCR的技术支持。
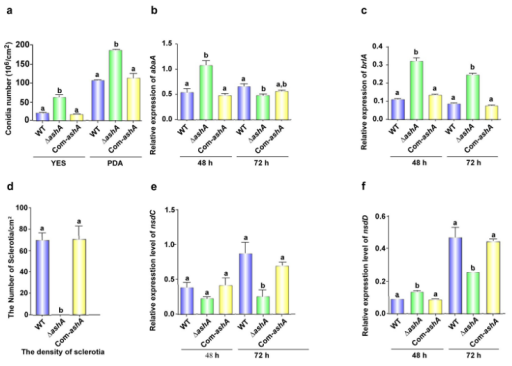
1. AshA在黄曲霉菌中保守,且是真菌形态建立所必需的对16个曲霉属真菌的AshA蛋白构建进化树,结果显示这些曲霉属聚为一个大簇。蛋白结构域分析表明在这16个真菌中存在一个SET结构域。构建ashA缺失突变体(△ashA)、ashA互补株(Com-ashA),将这两个突变体在YES和PDA培养基上培养4d。△ashA菌株的分生孢子和分生孢子梗产量增加(图1 a)。qRT-PCR结果表明AshA存在会在48h时增加abaA的表达水平(图1b),48和72小时brlA表达水平显著升高(图1c)。这些结果表明AshA在YES培养基上负调控真菌的无性繁殖。 为了评估AshA在菌核(耐药结构)组装中的作用,将上述真菌菌株在CM培养基上点培养。用70%乙醇去除局部菌丝和分生孢子后,计数菌核。结果表明△ashA菌株中没有发现菌核(图1d)。通过qRT-PCR检测菌核调控基因nsdC和nsdD的转录水平,结果发现在48和72小时nsdC的表达水平明显下降(图1e),nsdD在72小时也明显下调(图1f)。这些结果反映AshA在菌核发育中起着重要作用。
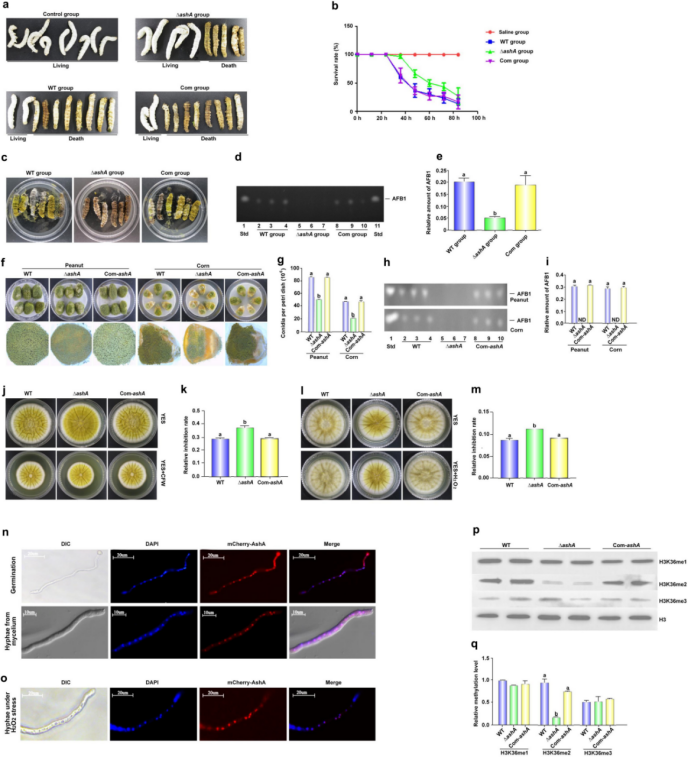
图1 AshA在黄曲霉发育和生物合成中的作用 2. AshA在AFB1的生物合成中是必不可少的将WT、△ashA和Com-ashA菌株在YES液体培养基中培养,测定其在黄曲霉素合成中的生物学功能,并于第6天收获菌丝并采用薄层色谱法分析。结果表明当AshA不存在时,AFB1的产量显著降低(图1g,h)。高效液相色谱分析进一步证实△ashA菌株几乎丧失了AFB1和AFB2的合成能力(图1i)。黄曲霉毒素合成基因及调控基因利用qRT-PCR监控,这些基因在72小时△ashA菌株中显著下调(图1j,k)。以上这些结果表明AshA通过正向调控相关生物合成基因簇来上调黄曲霉毒素的产生。 3. AshA在黄曲霉寄主毒力中起着重要作用
图2 AshA在黄曲霉对蚕和作物籽粒毒力中的作用,亚细胞定位及其催化的甲基化位点和水 4. AshA调节细胞核内的H3K36me2利用Western-blotting分析AshA作为甲基转移酶的酶促功能,将黄曲霉菌株制备的蛋白样品转移到NC膜上,用抗H3K4、H3K36和H3K79 1-3甲基化抗体进行检测,最终结果表明AshA主要催化H3K36me2(图2p,q)。 5. SET结构域在真菌毒力中起着重要作用6. SetB主要催化核内H3K36的三甲基化为了揭示SetB在H3K36甲基化过程中的催化作用,作者采用免疫印迹法检测了WT、ΔsetB、Com-ΔsetB、setBΔSET、ΔsetB/ashA和H3K36A真菌菌株中H3K36的所有甲基化水平。结果表明,当setB基因缺失后,几乎没有检测到H3K36me3,这反映了SetB催化了大部分的H3K36me3(图3a)。当SET结构域缺失时,也观察到相同的结果,这一结果推断它是催化H3K36me3的关键因素。 与WT菌株相比,ΔsetB和setBΔSET菌株中均明显检测到更多的H3K36me1和me2,说明H3K36me1和me2由于不能及时转化为H3K36me3而积累。当setB和ashA基因同时被删除时,H3K36的所有甲基化水平都被消除,就像点突变株H3K36A一样(图3a,b),由于甲基化位置赖氨酸36已经突变为丙氨酸,所以不会发生甲基化。结果表明,这两个属于甲基转移酶的Set2家族蛋白负责黄曲霉H3K36的甲基化。
7. SetB在真菌毒力中的作用进一步研究SetB在真菌毒素代谢中的作用,采用TLC(薄层色谱法)分析测定黄曲霉菌株AFB1的产生。在ΔsetB菌株中几乎没有检测到AFB1,进一步的qRT-PCR表明AFB1合成相关基因进行qRT-PCR,发现SetB通过黄曲霉素生物合成调控因子和催化酶调控AFB1的合成(图3l)。 此外,作者还将上述菌株感染玉米籽粒,观察孢子、菌丝生长情况,并对AFB1进行测定。总之,这部分的结果表明SetB深度参与该病原菌的发育、真菌毒素代谢和植物内核的定植。 8. SetB的SET结构域与真菌毒力有关9. SetB和AshA在真菌发育、毒素代谢和毒力方面的协同作用本研究还评估了Set2甲基转移酶家族在黄曲霉毒力中的作用。将上述菌株定植在玉米籽粒上,结果表明:与ΔsetB和setBΔSET菌株相比,被ΔsetB/ashA污染的玉米籽粒表面生长的菌丝和孢子明显减少(图3m,n)。加上之后的TLC分析,结果表明SetB与AshA合作,Set2家族在作物籽粒黄曲霉的真菌毒力和AFB1合成中起关键作用。 10. H3K36的甲基化调节真菌毒素代谢和真菌毒力11. Set2家族调控黄曲霉全基因组H3K36的三甲基化WT菌株中大部分上调富集峰定位于外显子(46.88%)和启动子(41.25%)区域。ChIP-seq分析中鉴定到5592个peaks,其中有2018个peaks是差异积累的(differently accumulated peaks,DAPs)。这2018个DAPs有1995个DAPs是显著积累在野生型菌株(红色)中,23个DAPs则是积累在ΔsetB/ashA菌株(绿色)中(图4a)。然后,作者做了GO和KEGG富集分析。以上这些结果证实了H3K36me3与该研究揭示的代谢过程、信号转导、生物调控、增殖和生长等各种重要生物过程的调控密切相关。
12. AshA和SetB通过H3K36在wetA和steA通路上的三甲基化直接调控真菌繁殖为了明确wetA活性是否受H3K36甲基化调控,ChIP-qPCR基因证明WT菌株中H3K36me3修饰的染色质片段(包括wetA基因启动子和ORF区域)的富集量均极显著高于ΔsetB/ashA菌株(图4f-h)。 转录因子SteA在Aspergillus nidulans有性繁殖中起着不可缺少的作用。黄曲霉的性生殖结构,即带有子囊孢子的子囊鱼,嵌在菌核。根据峰图,与ΔsetB/ashA菌株相比,WT菌株的steA的ORF区明显富集(图4i)。作者随后采用qRT-PCR和ChIP-qPCR验证。以上结果反映Set2家族甲基转移酶通过催化wetA启动子区和ORF染色质区H3K36me3直接促进无性繁殖,通过催化steA ORF染色质区H3K36me3促进有性生殖。 13. H3k36me3修饰aflR染色质区域直接上调AFB1合成代谢
14. Set2家族甲基转移酶通过底物供应促进真菌毒素合成代谢为了检测淀粉酶基因是否受到Set2家族甲基转移酶调控,作者进行了qRT-PCR实验。结果显示,与WT菌株相比,ΔsetB/ashA菌株淀粉酶基因的转录水平明显被抑制(图5h),说明淀粉酶基因受甲基转移酶家族的调控。为了检测直链淀粉是否参与真菌毒素合成代谢,构建了淀粉酶基因缺失株(ΔAFLA_084340)。薄层色谱分析,结果表明淀粉酶的缺失抑制了AFB1的产生。Set2甲基转移酶家族在底物利用水平上通过H3K36三甲基化上调AFB1合成代谢。
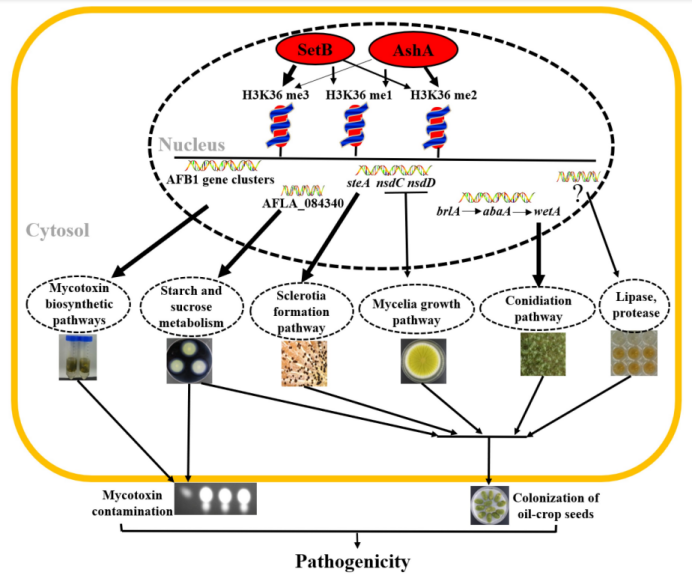
作者探索并阐明了黄曲霉中位于细胞核的Set2甲基转移酶家族的生物功能,并确定了由AshA和SetB介导的组蛋白甲基化对真菌毒素合成代谢和真菌对植物和动物毒性的影响。该研究揭示AshA和SetB负责黄曲霉中H3K36甲基化的所有水平,通过它们直接调节致病真菌的真菌毒素合成和真菌毒力。总之,该研究揭示了调控黄曲霉形态发生、真菌毒素合成代谢和真菌毒力属性的潜在表观遗传机制,为开发新的致病真菌预防和控制策略提供了新的视角。链接:https://pan.baidu.com/s/1SWGCqSTV12tWcrfDLqzIdw?pwd=bv5n 提取码:bv5n |