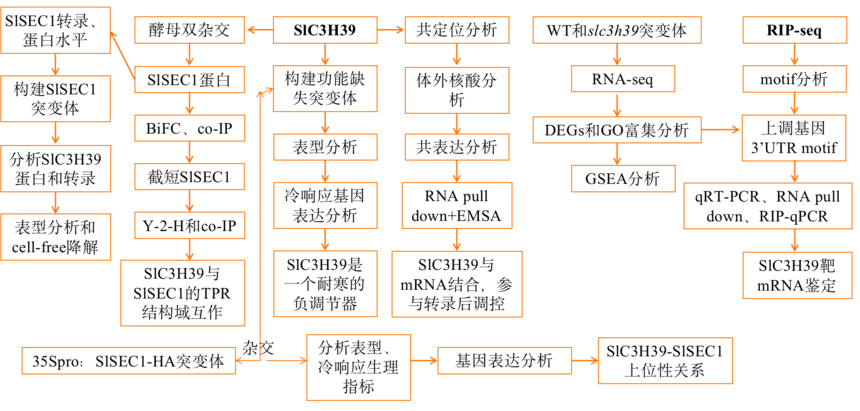
NEWS
新闻资讯
|
RIP-seq项目文章|IF=10.323 &New Phytol发表番茄耐寒的转录后调控机制期 刊:New Phytol 单 位:浙江大学 2022年10月25日,浙江大学紫金港校区园艺学系周艳虹教授团队在New Phytologist(IF=10.323!)上发表题为“SEC1-C3H39 module fine-tunes cold tolerance by mediating its target mRNAs degradationin tomato”的研究论文。该研究鉴定了一个冷诱导基因SlC3H39,该基因负向调节植物的耐寒性。研究发现SlC3H39在体外结合RNA并参与mRNA的降解。SlC3H39通过与冷响应基因的3‘UTR结合,调控番茄的耐寒性,诱导mRNAs衰变。该研究为番茄耐寒性的转录后调控机制提供了新见解。爱基百客为该研究提供RIP-seq的技术支持。
· 研究背景 在自然条件下,植物生长不可避免地受到温度、干旱、盐碱等极端环境的影响。其中,温度可以影响植物生长、发育甚至死亡。低温是主要的环境压力,损害了植物的生长和生产力,从而限制了植物的地理分布。植物已经进化出无数的机制来感知环境挑战,并在其生长中做出适当的调整,以抵御恶劣的环境并将损害最小化。在植物中,CCCH锌指蛋白调控其发育过程和抗逆性。既往研究表明,转录后调控是CCCH锌指蛋白的保守功能。然而,CCCH锌指蛋白通过转录后调控调节植物的胁迫耐受性的分子机制尚不清楚。
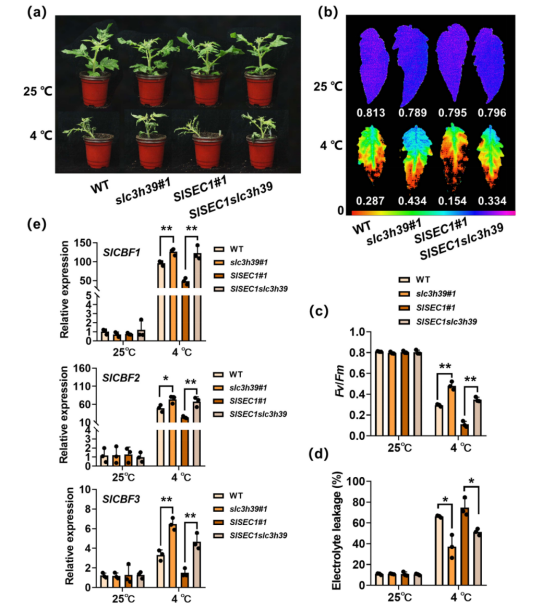
SlC3H39(Solyc05g052570)是一个串联CCCH锌指蛋白,其基因在冷胁迫下快速诱导表达(图1a)。为了进一步研究SlC3H39在番茄耐寒性中的调控功能,作者通过CRISPR/Cas9介导的基因编辑技术获得了两个稳定的功能缺失的SlC3H39突变体(slc3h39#1 和slc3h39#2)。当slc3h39突变体和野生型(WT)植株在25 度下生长时,slc3h39突变体生长相对较慢,具有半矮化表型(图1b)。在4度条件下,与野生型比较,突变体表现出冷敏感减少,更少的枯萎叶子,相对电解子泄漏减少,Fv/Fm增加。 冷响应基因SlCBF1、SlCBF2和SlCBF3在slc3h39植株中的表达也显著增加。这些观察结果表明,SlC3H39负调控番茄植株的耐寒性。然而,作者发现SlCBFs的转录本在冷暴露3h时达到峰值,然后逐渐下降。与SlCBFs相比,SlC3H39的表达在冷暴露6h时达到峰值。这些结果表明,冷诱导的SlC3H39的表达滞后于SlCBFs。
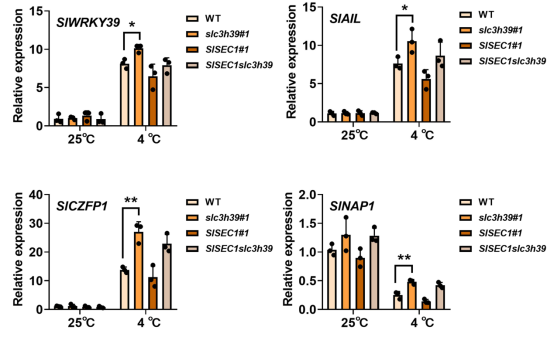
图1 串联CCCH锌指蛋白SlC3H39是耐寒性的负调控因子。 此前研究表明特定条件下TTP(三四脯氨酸)在P小体(PBs)和应急颗粒(SGs)之间流动。研究中,作者发现SlC3H39有类似于发现在动物TTP的TZFmotif,其可以同时结合DNA和RNA。SlC3H39与TTP具有相似的亚细胞定位,并使用烟草瞬时表达系统发现靶向于细胞质foci(图2b)。在动物中,这些细胞质foci类似于PBs和SGs,它们是多聚体解体后mRNA积累的位点。为了检测SlC3H39是否与PBs和SGs相关,作者使用PBs和SGs标记基因进行了共定位分析。SlC3H39-GFP与DCP2和XRN4共定位于细胞质foci(图2c)。同时,SlC3H39-GFP与SG标记基因PABP8共定位。因此,作者推测SlC3H39也能与DNA或RNA结合。 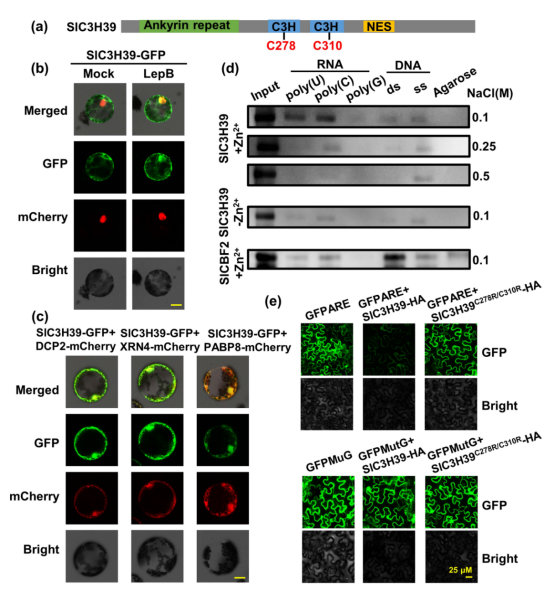 图2 SlC3H39通过与mRNA结合,参与转录后调控。 基于SlC3H39通过介导mRNA降解在植物转录后调控中的潜在作用。作者预测由SlC3H39直接调控的基因将会在slc3h39突变体中上调表达。为了在全基因组范围内筛选SlC3H39的直接靶点,作者在WT和slc3h39突变体中进行RNA-seq。对差异表达基因进行了统计和GO富集分析。GSEA分析显示与野生型比较,在slc3h39突变体中,参与防御反应和应激反应的基因表达上调,而参与分生组织发育和光合作用等生长的基因表达下调。 为了鉴定SlC3H39的靶RNA,作者选取了7日龄番茄幼苗在4°C处理6小时后,进行RNA免疫沉淀(RIP-seq)实验,在全基因组范围内确定SlC3H39蛋白体内的RNA结合位点。为了鉴定SlC3H39结合motif,借助MEME对这些peaks进行从头motif分析,结果显示一个富AUmotif出现明显的富集(图3b)。与WT相比,在slc3h39突变体中上调的2044个基因中,作者鉴定出209个含有上述3‘UTR 富AUmotif的基因,推测为slc3h39结合基因。对这些预测的基因进行分析,发现4°C条件下82基因上调,43个基因下调(图3c,d)。 作者随后研究了SlC3H39是否与这些基因的3‘UTR结合并介导转录本的衰减。从209个假定的SlC3H39结合基因中选择出来SlWRKY39、SlAIL、SlCZFP1和SlNAP1,这些基因在3‘UTR中含有富AUmotif,对低温有显著反应(图3e)。先前的研究表明,SlCZFP1诱导了冷反应基因的组成性表达,并增强了冷冻或耐寒性。SlWRKY39和SlNAP1都是番茄抗生物和非生物胁迫的正调控因子。 作者采用qRT-PCR分析了这些基因对寒冷反应的表达模式。在4°C条件下,SlWRKY39、SlAIL和SlCZFP1表达上调,SlNAP1表达下调。然后,作者他们检测了这些基因的3‘UTR是否能诱导slc3h39介导的mRNA降解。事实上,将SlC3H39-HA和修饰的GFP基因与SlWRKY39、SlAIL、SlCZFP1和SlNAP1的3‘UTR融合,导致GFP荧光显著降低(图3f)。RNA pull down实验进一步支持了SlC3H39与SlWRKY39、SlAIL、SlCZFP1和SlNAP1的3‘UTR相互作用。RIP-qPCR也证实了它们的互作关系。使用抗SlC3H39抗体在共免疫沉淀RNA中检测到SlWRKY39、SlAIL、SlCZFP1和SlNAP1的3‘UTR片段的富集。综上所述,SlC3H39通过结合冷反应基因的3‘UTR并破坏这些转录本,通过转录后调控来调节植物的耐寒性。
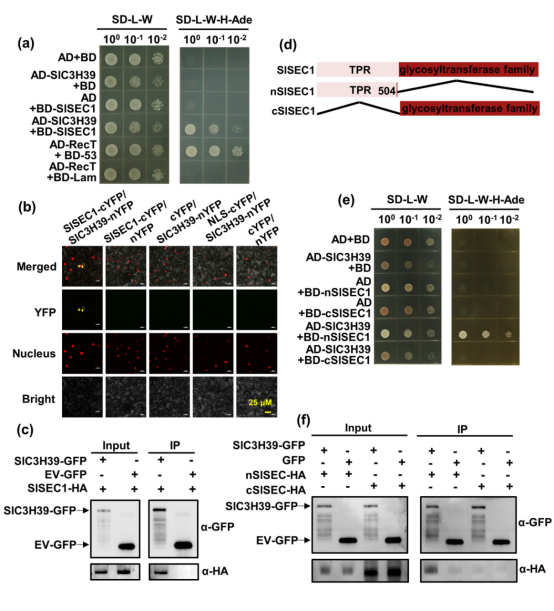
为了进一步研究SlC3H39调节耐寒性的潜在机制,作者首先通过酵母双杂交方法筛选了SlC3H39的相互作用蛋白,得到了一个SlSEC1蛋白。然后,作者利用了BiFC、co-IP技术手段证实了SlC3H39为SlSEC1的相互作用蛋白。为了进一步确定介导SlC3H39和SlSEC1之间物理相互作用的结构域,作者与截短蛋白进行了Y-2-H和co-IP实验。研究结果显示SlC3H39与介导底物识别的SlSEC1的TPR结构域相互作用。
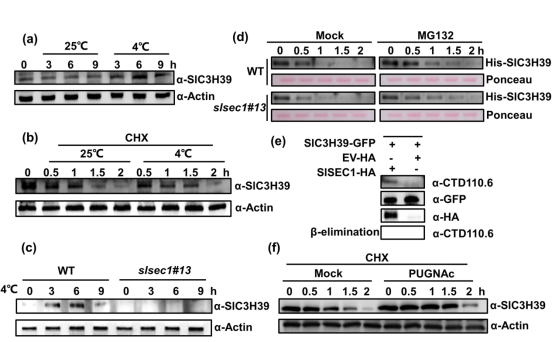
由于SlC3H39的转录本是在寒冷中诱导的,作者研究了SlC3H39是否可能受到翻译后调控。作者首先检测了寒冷下蛋白积累,冷暴露6h后,SlC3H39蛋白水平显著升高,这与冷处理下SlC3H39转录本的变化一致。此外,作者用环己酰亚胺(CHX)处理后的蛋白印迹法检测其稳定性,CHX可以抑制从头蛋白的生物合成。作者发现,在CHX处理1.5小时后,SlC3H39蛋白水平显著下降,而在随后的2小时内几乎没有检测不到。而4°C下1.5 h时的SlC3H39蛋白水平显著高于25°C时(图5b)。 在冷胁迫下,作者也检测到SlSEC1转录水平的引入。与SlC3H39一致,SlSEC1的转录本在冷暴露6h时达到峰值,然后下降。因此,作者推测SlSEC1可能会影响SlC3H39蛋白的稳定性。为了验证这一假设,作者测量了WT和slsec1突变体中的SlC3H39蛋白和转录本水平。同样的利用CRISPR/Cas9系统,构建了slsec1的2个稳定功能缺失突变体(slsec1#13 和slsec1#14),它们无明显的生长缺陷,但生长速度较野生型植株稍慢。结果显示,在slsec1中未检测到SlC3H39蛋白。而与野生型植株相比,slsec1中的SlC3H39转录水平保持不变。这暗示SlSEC1对SlC3H39稳定性的调控是在转录后水平。cell-free降解实验也证实了这一结论。
图5 SlSEC1促进了SlC3H39的稳定性
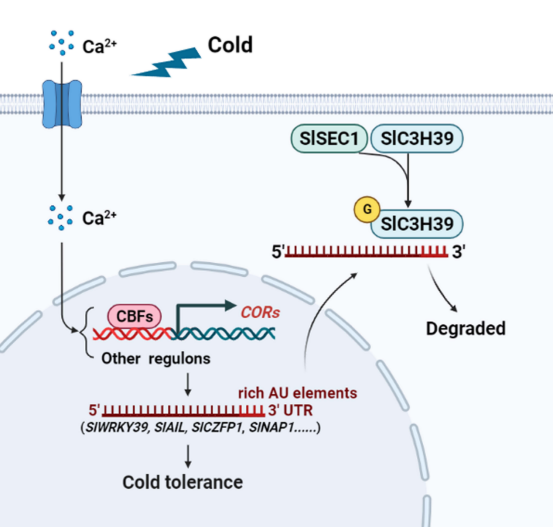
◆ 总 结 ◆ 作者提出了一个植物耐寒机制的更新模型:冷传感器将冷刺激转导或转化为细胞内信号,以激活由SlC3H39和SlSEC1介导的冷反应通路。在这个模型中,3‘UTR中含有富AU元件的冷响应转录本,如SlWRKY39、SlAIL、SlCZFP1和SlNAP1与SlC3H39结合并随后降解,这允许植物在胁迫下平衡防御反应和生长过程。一个O-GlcNAc转移酶SlSEC1作为SlC3H39的相互作用蛋白,促进SlC3H39的稳定性。作者认为未来的研究将集中于O-GlcNAc信号通路如何响应环境刺激,并影响植物的生长和防御。
◆ RIP-seq产品介绍 ◆ |