NEWS
新闻资讯
|
项目文章 | ChIP-seq再立功,爱基百客助力南开大学程志晖团队发表病原微生物CtrA的调控机制
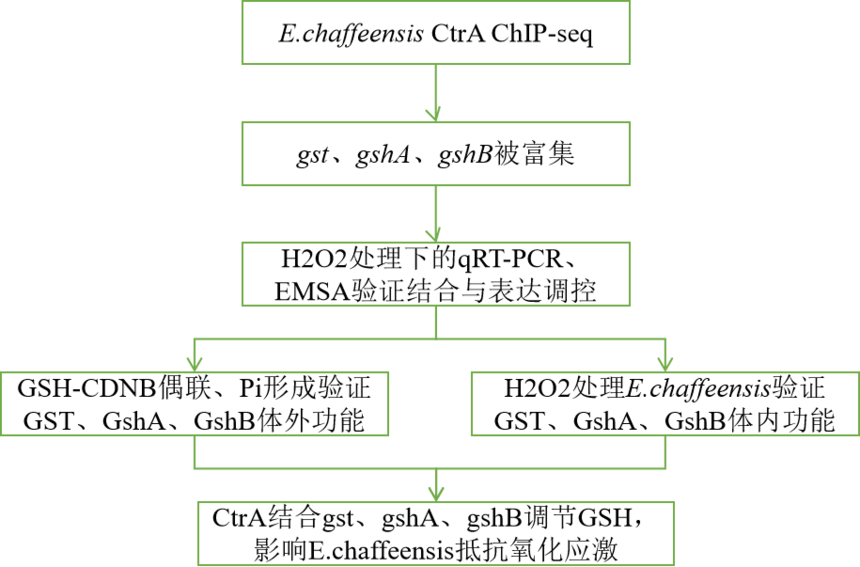
客户单位:南开大学 期刊:Frontiers in Cellular and Infection Microbiology(IF:6.073) 核心干实验:ChIP-seq(爱基百客提供) 01 技术背景 Ehrlichia chaffeensis(查菲埃立克体)是一种革兰氏阴性的强制性细胞内细菌,优先感染人类单核细胞或巨噬细胞,并引起人类单核细胞埃利希体病(HME)。HME是一种最流行的、威胁生命的新发人畜共患病,临床症状为头痛、发烧、肌痛、乏力伴贫血、白细胞减少、血小板减少和转氨酶升高。近40-60%的患者需要住院治疗,死亡率约为3%。 CtrA是双组分调控系统CckA/CtrA的一种反应调节因子,在变形菌门Anplasmataceae(无形小体科)家族的所有测序成员中保守。CtrA保守结合基序是TTAA-N7-TTAAC (9-mer)和TTAACCAT(8-mer)。在E.chaffeensis中,CtrA与bolA、surE、ompA、gshA和gshB的启动子区域结合并激活其表达,所有这5个基因都是E.chaffeensis感染和生存的关键。但这种调控机制在同家族其他成员如C.crescentus中不存在,表明E.chaffeensis具有独特的CtrA调控机制,并导致对其专性细胞内生长的适应。然而,E.chaffeensis中的CtrA调控机制尚未完全阐明。 在宿主经受感染后,免疫细胞能够通过产生活性氧(ROS)来杀死病原体。前人发现E.chaffeensis EtpE能够阻断ROS的生成,Etf-1上调宿主锰超氧化物歧化酶(MnSOD)以降低巨噬细胞中的ROS水平,但不能抑制中性粒细胞产生ROS,其响应其他细胞ROS的机制在很大程度上仍然未知。 GshA和GshB是两种酶,催化L-谷氨酸(L-Glu)、L-半胱氨酸(L-Cys)和L-甘氨酸(L-Gly)合成最有效的天然抗氧化剂谷胱甘肽(GSH)。在E.chaffeensis中,作者发现氧化应激时CtrA激活了GshA和GshB的表达。在细菌中,谷胱甘肽可被谷胱甘肽过氧化物酶(GPx)和谷胱甘肽s-转移酶(gst)利用来消除ROS。然而,E.chaffeensis缺乏GPx,并且只编码一个GST(ECH_0847)。E.chaffeensis gst的功能和调控仍有待进一步研究。在本研究中,为了深入了解CtrA在E.chaffeensis中的调控,作者进行了ChIP-seq,并确定了包括gst在内的211个基因受CtrA调控。随后通过体外酶学分析和体内敲除肽核酸(PNA),验证了gst的功能。 02 技术线路
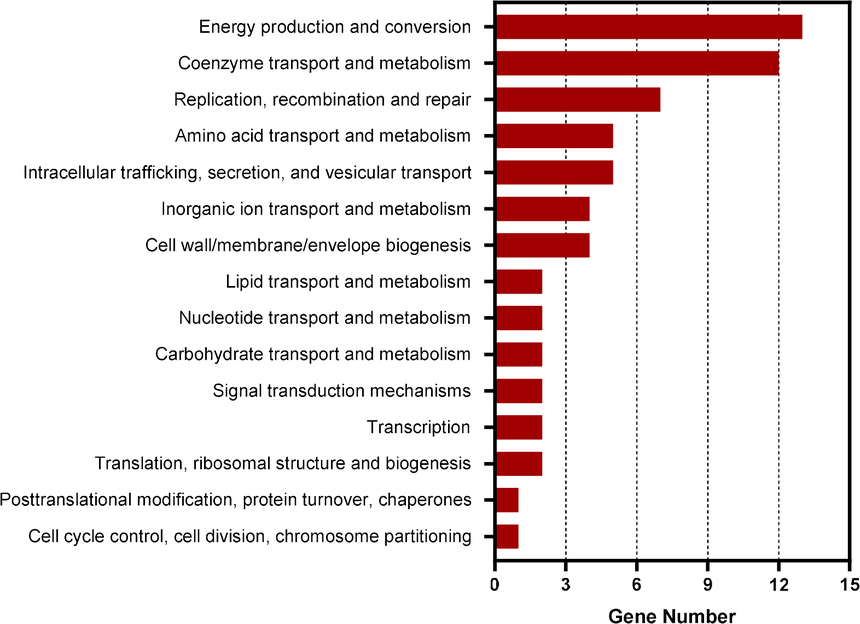
03 研究结果 为了鉴定E.chaffeensis中CtrA调控的基因,作者首先进行了ChIP-seq实验。发现211个基因的启动子区域富集。COG分析显示,这些基因参与辅酶转运代谢、能量产生和转化、复制、重组和修复等多种功能(图1)。与前期研究一致,gst、ctrA、bolA、surE、gshB、gshA和ompA启动子区也被富集。 在这些富集的基因中,GST是一种酶,能够催化GSH与ROS的反应,然后消除ROS。作者使用pDRAW32 DNA分析软件(http://acaclone.com/)在gst启动子区域发现了一个9-mer CtrA结合基序(TTAA-N7-TTAAC)。这些结果表明,CtrA可调控E.chaffeensis中gst的表达。
为了确认gst的表达是否受到CtrA的调控,作者利用qRT-PCR检测了同步培养的E.chaffeensis在THP-1细胞中的gst表达模式。CtrA在E.chaffeensis细胞内生长后期表达,而同时,在E.chaffeensis细胞内生长后期,gst的表达也上调(图2A),说明gst的表达可能受到CtrA的调控。 GshA和GshB分别是谷氨酸-半胱氨酸连接酶和谷胱甘肽合成酶,催化从L-Glu,L-Gly,L-Cys和ATP合成GSH。此前发现CtrA在氧化应激时激活E.chaffeensis中GshA和GshB的表达。然后作者研究了氧化应激时CtrA是否激活了gst的表达。PNA是一种DNA模拟物,能以高亲和力和特异性结合单链和双链DNA和RNA,并可用于降低E.chaffeensis蛋白水平。用CtrA PNA(蛋白表达会被敲低)或CTL PNA(对照)转染无宿主细胞的E.chaffeensis,随后感染THP-1细胞并用H2O2处理。作者发现,经H2O2处理后,转染CTL PNA的E.chaffeensis中gst的表达显著上调,而CtrA PNA的gst表达无明显变化(图2B)。这表明gst可能是赋予E.chaffeensis抗氧化应激能力所必需的,且其受到CtrA的调控。然后作者使用GST-rCtrA进行EMSA,结果表明CtrA直接与E.chaffeensis的gst启动子结合(图2C)。 由于在E.chaffeensis中缺乏有效的遗传操作方法,为了研究CtrA是否激活了gst的表达,作者生成了gst启动子-EGFP融合结构,并对含有E.chaffeensis ctrA基因的pACYCDuet-1载体(pACYCDuet-1-rCtrA)或仅含pACYCDuet-1载体(阴性对照)的大肠杆菌BL21(DE3)细胞进行转化。IPTG诱导的rCtrA表达导致携带gst启动子-EGFP结构的细菌中EGFP表达明显高于载体对照,而对携带p28启动子-EGFP结构的细菌无影响(图2D)。这些结果表明,CtrA激活了E.chaffeensis中gst的表达。
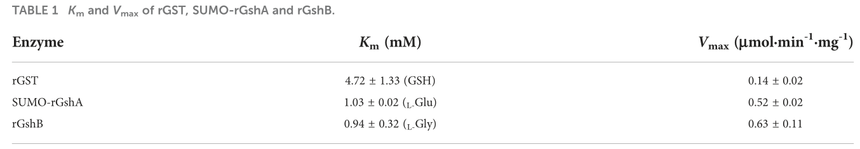
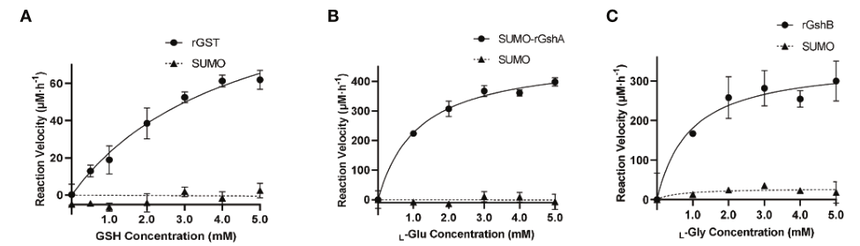
图2 CtrA结合到gst启动子区域,在氧化应激时激活gst的表达 接下来,作者确定了体外GST、GshA和GshB的功能。作者在体外表达了GST、GshA和GshB,随后通过GSH-CDNB偶联形成、Pi的形成测定了体外蛋白的酶活性(表1;图3)。结果表明,E.chaffeensis rGST具有功能性,其对GSH的Km值与之前报道的A.tumefaciens GST的Km值在相似的范围内;并且SUMO-rGshA和rGshB具有功能,L-Glu和L-Gly的Km值与A.tumefaciens GshA和大肠杆菌GshB的Km值在相似的范围内。这些结果表明GST、GshA和GshB是E.chaffeensis中的一种功能酶,催化GSH与其典型底物CDNB的偶联。
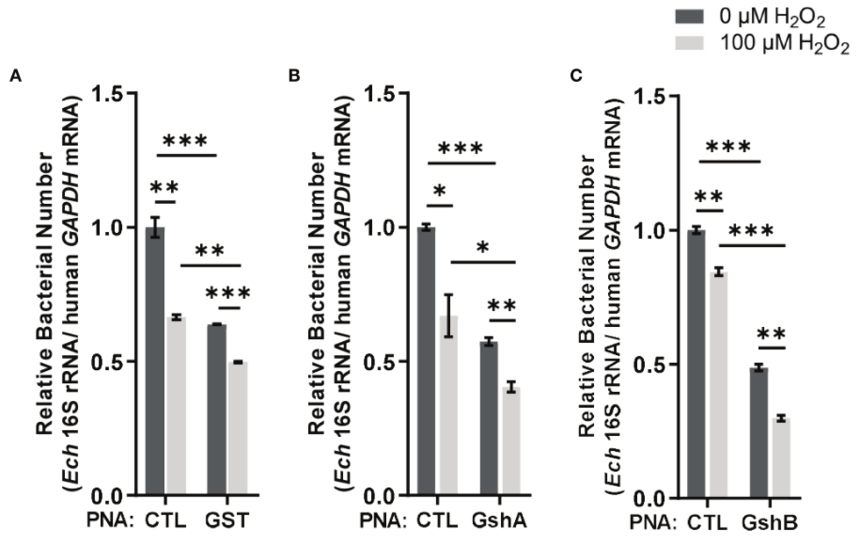
图3 E.chaffeensis GST、GshA和GshB在体外的酶活实验 由于E.chaffeensis GST在体外具有功能,作者随后研究了其在体内的功能。作者设计了特异性结合到gst翻译起始密码子后区域的GST PNA,GST PNA在36 h p.i时显著降低了gst mRNA水平(图4)。然后,作者研究了GST表达的降低是否影响氧化应激下细菌的生存。在36 h p.i.时,将感染的THP-1细胞在37℃下用100 mM H2O2处理2 h。经GST PNA转染的E.chaffeensis存活能力显著低于经H2O2处理的E.chaffeensis CTL PNA(图5A),这表明gst对E.chaffeensis应对氧化应激至关重要。 作者还测定了转染GshA PNA或GshB PNA的E.chaffeensis在氧化应激下的生存能力。作者设计了GshA PNA和GshB PNA,同样发现转染无细胞E.chaffeensis的GshA PNA或GshB PNA在36小时后显著降低gshA或gshB mRNA水平(图4)。36h p.i时,用H2O2处理感染的THP-1细胞,转染GshA PNA或GshB PNA的E.chaffeensis的生存能力也显著低于转染CTL PNA的E.chaffeensis(图5B,C)。综上所述,GSH的合成和利用是E.chaffeensis应对氧化应激的关键。 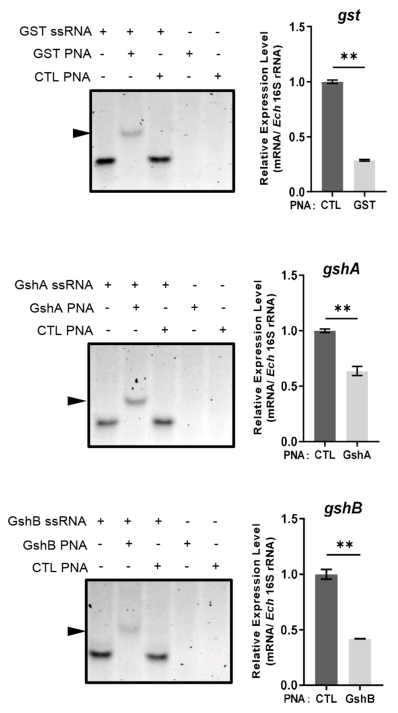
图5转染GST PNA(A)、GshA PNA(B)或GshB PNA(C)后E.chaffeensis生存能力检测 04 总 结 Ehrlichia Chaffeensis是人单核细胞埃利希体病(HME)的病原体,是一种革兰氏阴性强制性细胞内细菌,在人单核细胞和巨噬细胞中感染和繁殖。宿主免疫细胞在感染后产生活性氧(ROS)来消灭E.chaffeensis。在本研究中,作者发现E.chaffeensis中CtrA在氧化应激时激活谷胱甘肽s -转移酶(GST)的表达,而E.chaffeensis gst利用GSH清除ROS,使其具有抗氧化应激能力。随后,利用染色质免疫沉淀偶联深度测序(ChIP-seq),作者发现CtrA与211个基因的启动子区结合,包括gst、gshA和gshB并激活这些基因的表达,而这些基因的表达降低能够抑制E.chaffeensis应对氧化应激。 |