NEWS
新闻资讯
|
项目文章解读 | DNA低甲基化介导的桂花衰老
前 言 桂花(osmanthus fragrans Lour.)是中国最受欢迎的十大传统花卉之一,被广泛用于观赏、食品/化妆品添加剂等。但其花期普遍较短,最佳商业采收期仅为2-3 d,极大地限制了其观赏价值和经济可行性。内源性乙烯的产生是花衰老的重要调节因子。乙烯增强了DNA碎片,破坏亚细胞结构,导致花瓣脱落。然而,桂花内源乙烯产生的机制和花从开放到衰老的过程尚不清楚。已有研究表明,DNA甲基化参与调控果实成熟和叶片衰老(如番茄、拟南芥等)。然而,DNA甲基化在调控桂花开花和衰老中的作用尚不清楚。 为此,湖北科技学院陈洪国教授团队于2023年1月在园艺学科领域一区杂志Postharvest Biology and Technology(IF:6.751)上发表题为DNA hypomethylation mediates flower opening and senescence in sweet osmanthus through auxin and ethylene responsive pathways的研究性论文。该研究利用亚硫酸氢盐测序技术与转录组技术(均为爱基百客完成)对不同花期的桂花进行了多组学分析,探究使花进入开放和衰老的可能表观遗传机制。湖北科技学院国家林业草原桂花工程技术研究中心陈洪国教授和华中农业大学园艺林学学院王彩云教授为共同通讯作者,湖北科技学院邹晶晶和蔡璇副教授为共同第一作者。 技术路线
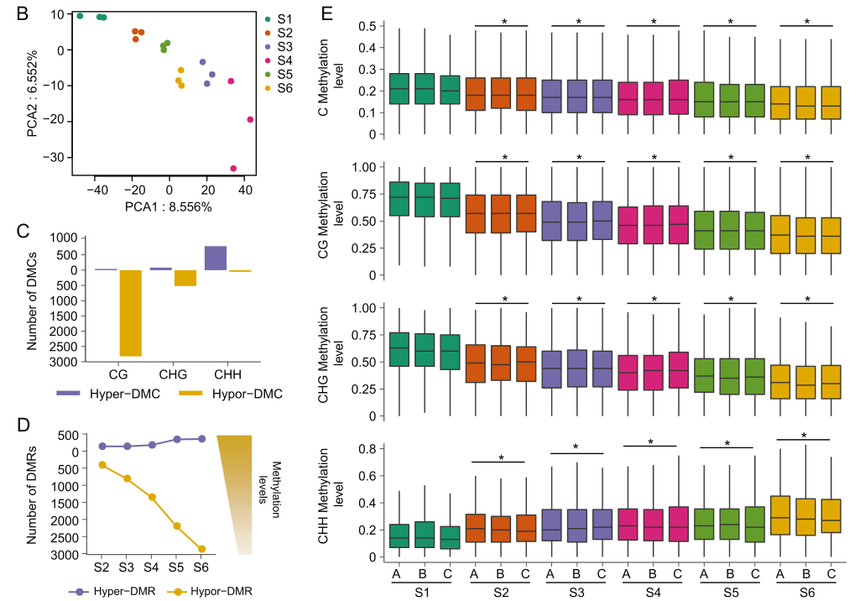
研究结果 为了研究DNA甲基化对桂花开放和衰老的影响,作者对六个花期的花进行了全基因组亚硫酸氢盐测序和转录组测序。其中甲基化(mC)的比例平均为19%,mCG、mCHG和mCHH的平均比例分别为72%、43%和8%,表明cg型DNA甲基化占主导地位。主成分分析显示,三个生物样品在各花期的一致性较好(图1B)。为了表征开花和衰老过程中DNA甲基化的动态变化,作者对差异甲基化胞嘧啶(DMCs)和差异甲基化区(DMRs)进行了分析。相比衰老时期,花蕾期鉴定出4308个DMCs,其中79%为低甲基化DMCs(hypo-DMCs)且主要为CG类型(图1C)。这一结果表明,DNA去甲基化可能发生在开花期间,并且主要归因于CG甲基化的降低。与S1相比,S2(407)、S3(805)、S4(1348)、S5(2197)和S6(2867)位点鉴定出的hypo-DMRs数量随着开花的进展而明显增加(图1D),这进一步说明DNA去甲基化发生在花的开放和衰老过程中。
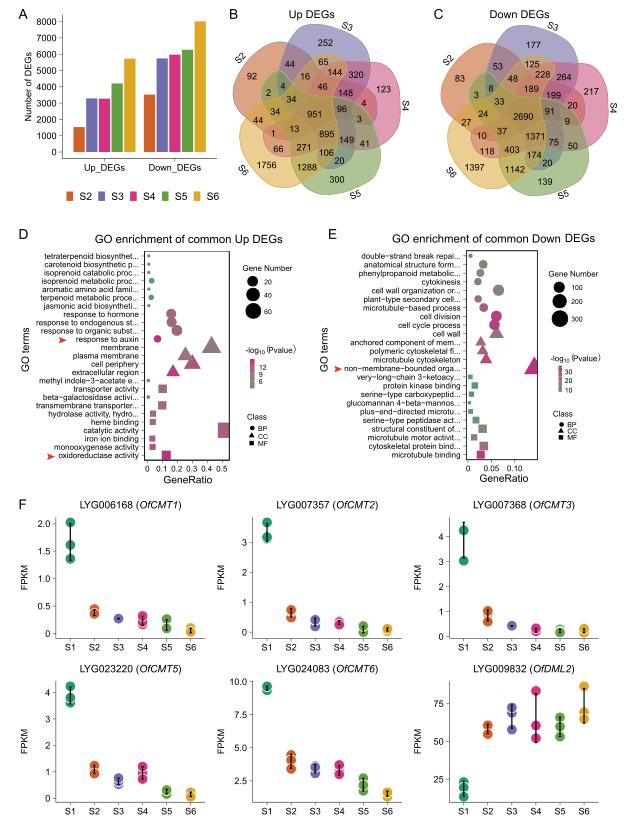
图1 桂花开花过程中DNA甲基化的缺失 此前在番茄果实发育过程中,发现了DNA低甲基化伴随CHH高甲基化。为了探索桂花的这种可能性,作者测定了CG、CHG和CHH环境下的DNA甲基化百分比。在S6和S1之间的低DMRs中,在CG和CHG环境中检测到低甲基化,而在CHH环境中检测到高甲基化(图1E)。这些结果表明,桂花开花期间CG低甲基化也伴随着CHH高甲基化。 综上所述,在花的开放和衰老过程中,DNA甲基化程度降低,且以CG型DNA甲基化为主。 为了研究DNA低甲基化在开花过程中对基因调控的影响,作者生成了六个开花阶段的转录组谱。与S1相比,从S2到S6,上调和下调的DEGs数量逐渐增加(图2A),表明在开花和衰老期间,全局基因表达被激活。对S2、S3、S4、S5和S6相对于S1位点的DEGs进行GO分析发现,在上调的DEGs中,与氧化还原酶活性和对生长素反应相关的基因富集程度最高(图2D)。 KEGG分析表明,氧化还原酶途径中与类胡萝卜素和α-亚麻酸代谢相关的基因富集程度最高,提示类胡萝卜素和茉莉酸的合成可能是开花过程中重要的生物学过程。相比之下,与无膜细胞器和微管结合相关的DEGs在下调的DEGs中富集程度最高(图2E)。进一步分析表明,微管结合途径中富集的成员多为运动蛋白样蛋白,据报道,这些蛋白会影响纤维素微丝的排列顺序,从而影响细胞强度。无膜细胞器中富集最显著的基因与核糖体相关,核糖体可能参与花期蛋白质代谢的调控。
图2 开花过程中DNA甲基转移酶和脱氧甲基化酶基因的转录组分析及表达模式 DNA甲基化的动态变化通常由DNA甲基转移酶和DNA去甲基化酶的活性介导。CG和CHG甲基化通常由DNA甲基转移酶甲基转移酶1(MET1)和色甲基化酶3(CMT3)维持,而CHH甲基化主要由CMT2维持。DNA去甲基化通常受去甲基化酶的影响,包括ROS1、DME和DML基因。 为了探索哪些编码这些酶的基因有助于桂花DNA低甲基化,作者在桂花基因组中鉴定了DNA甲基转移酶和去甲基化酶的同源物。共鉴定出12个甲基转移酶基因和4个去甲基酶基因。在这些基因中,5个OfCMT基因在开花过程中显著下调,1个OfDML2基因在开花过程中显著上调(图2F)。这些结果表明,OfCMT和OfDML2基因可能参与了开花过程中DNA的低甲基化,这与番茄和辣椒的果实成熟过程类似。 为了研究DNA低甲基化在花开放和衰老中的作用,作者对S6和S1之间的低DMRs基因与DEG进行了关联。在开花期间,低DMR相关的上调的DEG数量逐渐增加,并在S6达到最大值(图3A),表明DNA低甲基化在开花期间介导了越来越多的基因激活。Venn图显示,1444个DEGs不与其他阶段重叠,在S6特异上调(图3B)。说明DNA去甲基化在花衰老后期起着重要的调控作用。 对S2、S3、S4、S5和S6相对于S1的低DMR相关DEGs富集GO项的分析表明,DNA低甲基化通过不同生物学途径的特定基因调控开花和衰老过程(图3C)。在花开早期(S2),果胶酯酶抑制因子是GO富集最显著的项,这表明细胞壁的修饰对花瓣花开初期很重要(图3C)。此外,在大部分开花过程中,最显著富集的基因是OfSAURs(生长素响应基因),并在S3到S5期间表达量急剧增加(图3D),这表明生长素反应通路中基因的DNA低甲基化对花瓣的扩张至关重要。 共1444个与hypo-DMR相关的上调的DEGs在S6特异表达(图B),明显多于其他阶段,说明在这一阶段发生了明显的转变,S6时额外的生物过程在花中被激活。衰老花中最显著富集的基因与DNA结合转录因子活性相关(GO:0003700)(图3C),表明花衰老主要受TF网络调控。为了进一步阐明哪些用于花衰老的转录因子是由DNA低甲基化介导的,作者对桂花中所有与低DMR相关的转录因子进行了分析,并在PlantTFDB数据库中标注。结果发现OfERF和OfWRKY TF家族成员分别在S5和S6显著富集和上调(图E),表明去甲基化可能通过激活特定的关键TF来介导花的衰老。
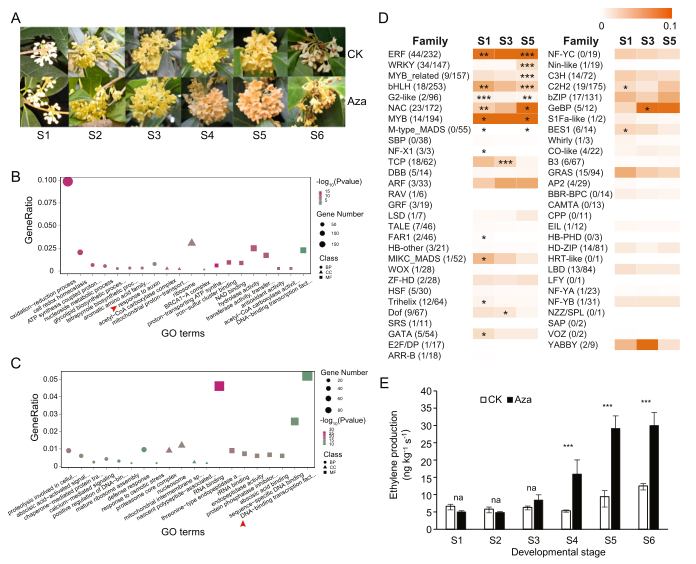
图3 DNA低甲基化通过生长素和乙烯反应途径介导花的开放和衰老 这些结果表明,DNA低甲基化可能通过影响与生长素和乙烯反应途径相关的特定基因家族(如OfSAUR、OfWRKY和OfERF TF家族)的表达来促进花的开放和衰老。 为了验证DNA低甲基化在桂花开放和衰老中的作用,在花蕾期对DNA甲基化抑制剂5-氮胞嘧啶(Aza)进行了喷洒。与对照相比,Aza处理后桂花的形态发生了明显变化。在Aza处理下,花期加快,花色由黄色明显转变为橙色(图4A),这表明DNA甲基化抑制剂触发了早开放和衰老表型。为了寻找DNA低甲基化对基因表达的调控机制,作者对Aza和ddH2O处理后S1、S3和S5花的转录组进行了分析。对富集GO项的分析显示,在Aza处理下,OfSAUR转录本显著富集(图4B),并在盛花早期(S3)上调差异表达。此外,Aza处理后,与DNA结合TF活性相关的转录本在开花后期(S5)显著富集(图4C),其中OfSAUR家族的成员在S5位点富集程度最高,表达量也最高(图4D)。这些结果再次表明,DNA低甲基化通过激活OfSAUR和OfERF基因的表达介导花的开放和衰老。 为了探究DNA低甲基化是否通过乙烯合成途径参与花的衰老,作者定量了对Aza反应的内源乙烯产量。Aza处理显著增加了盛花期内源乙烯的释放(S4)(图E),表明DNA低甲基化可能参与了乙烯生物合成的调控。
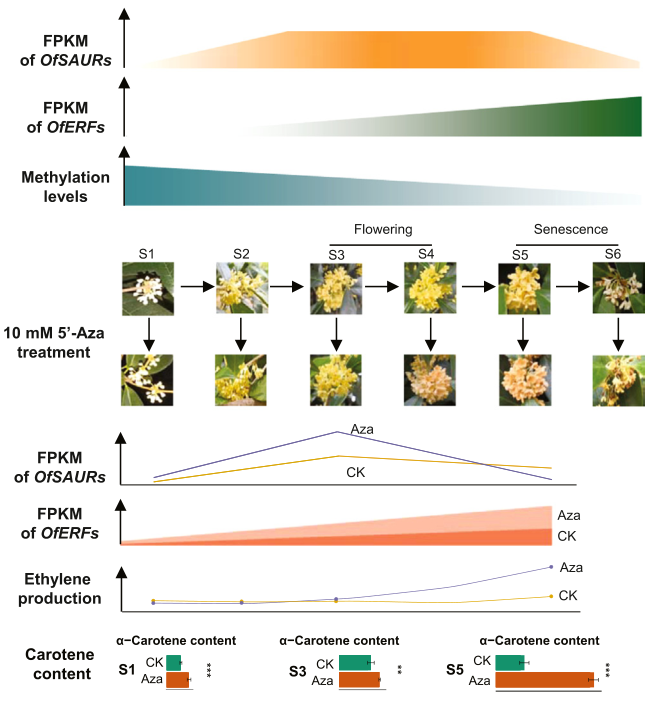
图4 DNA甲基化抑制剂引发早熟和衰老表型 综上所述,DNA甲基化抑制处理的反应证实,DNA去甲基化通过激活与生长素和乙烯反应通路相关的OfSAUR和OfERF基因家族成员,介导桂花开放和衰老的调控。 研究结论 本研究通过对桂花全基因组DNA甲基化和转录组谱的综合分析,揭示了DNA去甲基化在桂花开花过程中起着重要作用。DNA低甲基化可能通过生长素反应途径OfSAUR基因介导花开放,并通过乙烯合成和反应途径OfERF基因介导花衰老。最终,作者提出了一种表观遗传调控三组分模型(图5),在该模型中,花的开放和衰老由DNA去甲基化调控,通过介导特定基因家族的表达,以及植物激素生长素和乙烯,将花转变为开放和衰老的状态。DNA低甲基化介导OSUAR和OfERF基因调控桂花开放和衰老的分子机制有待进一步研究。
图5 表观遗传调控三组分模型 |