NEWS
新闻资讯
|
Plos Pathogenes | 表观遗传景观变化使EB病毒感染的B淋巴细胞在中枢神经系统中的运输成为可能EB病毒相关疾病已经是全球重要的健康问题。EBV是一种Ⅰ类致癌病原,占人类恶性肿瘤(包括上皮性和淋巴源性肿瘤)的1.5%。此外,EBV在许多非肿瘤性疾病中起着病因学和致病作用,甚至参与多种自身免疫性疾病(SADs)。今天我们和大家分享一篇EB病毒阳性B细胞在中枢神经系统中转运机制的研究文章。
Epstein-Barr virus (EBV)感染无处不在,EBV是多种淋巴和上皮恶性肿瘤的病原体,比如霍奇金淋巴瘤、NK/T细胞淋巴瘤、鼻咽癌和胃癌。EBV感染除与其相关的中枢神经系统恶性肿瘤外,越来越多的证据支持EBV与影响中枢神经系统的自身免疫性疾病(包括多发性系统硬化症MS和红斑狼疮SLE)有关。MS患者几乎都是EBV阳性,在MS患者脑部病变中,脑浸润的B细胞存在EBV感染,EBV在MS发病机制尚不清楚。 EBV阳性B细胞在中枢神经系统(CNS)中的转运是原发性中枢神经系统淋巴瘤(PCNSL)发展的关键步骤,并且在MS的发病机制中也起到重要作用。然而促进EBV阳性B细胞进入CNS的决定因素尚未明确。为了更好的了解促进EBV阳性B细胞进入中枢神经系统的机制,作者使用神经适应性的EBV阳性B细胞系(MUN14)建立小鼠模型,再利用ATAC-seq、RNA-seq、ChIP-qPCR技术发现表观遗传景观变化给EBV+B运输提供环境,并且发现secreted phosphoprotein 1 (SPP1)和osteopontin (OPN)促进EBV+B在CNS的转运。
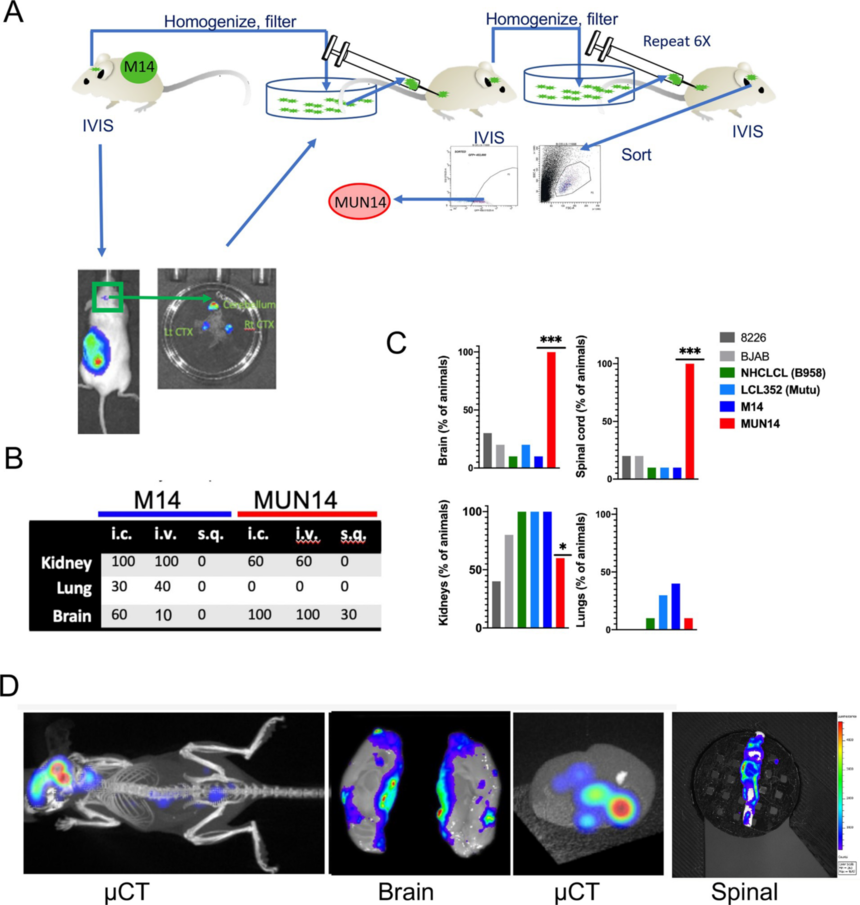
1. 强中枢神经系统运输的EBV阳性BL细胞系的构建 建立EBV阳性B细胞向中枢神经系统运输的小鼠模型,首先将GFP和firefly luciferase的表达载体转入EBV+伯基特淋巴瘤(BL)细胞系Mutu I (M14)中,使用IVIS生物发光成像系统进行体内可视化检测(图1A)。皮下移植M14细胞,监测其在中枢神经系统定位。观察到 (3/86)在小鼠大脑中有微弱的发光信号。 为了富集这一罕见细胞亚群,作者从大脑中分离出M14细胞,在体外确认GFP阳性信号,然后通过过滤、GFP流式分选、体外培养和再移植到小鼠体内富集。作者重复这一过程7个周期,每次连续传代神经侵袭率增加,最终产生新的神经适应EBV+淋巴瘤亚系MUN14 (图1)。当M14和MUN14细胞通过心内(i.c)、静脉(i.v)或皮下途径(s.q)植入时运输定植比例更高(图1B;(n = 10 /组),表明MUN14比M14更具神经侵袭性。 为了确定MUN14是否比其他EBV+ B细胞系更具有神经侵袭性,作者比较了MUN14与EBV- b958 (HCLCL)或EBV Mutu I (LCL352)在静脉注射后的神经侵袭性。同样,植入MUN14的动物的脑和脊髓中有生物发光信号显示神经侵袭率显著高于其他EBV+和EBV- b细胞系(图1C)。值得注意的是,EBV-多发性骨髓瘤line 8226经常出现在关节、颌骨、脊柱和颅骨。然而,当研究结束切除大脑和脊髓并成像时,仅在30%的大脑和20%的脊髓中检测到8226,与EBV+ LCLs和M14相似。尽管在一些动物的肾脏中可以检测到MUN14细胞,但μCT离体成像显示MUN14主要定位于中枢神经系统(脑和脊髓)(图1D)。
图1神经适应性(MUN14) EBV+ B细胞淋巴瘤的获得及分布 2. MUN14 B细胞亚群可增强神经侵袭和神经炎症 为了进一步研究MUN14的神经侵袭潜能,作者通过心内途径测量了MUN14和M14移植小鼠头部的生物发光信号。光谱IVIS CT的生物发光成像显示,在植入MUN14细胞的动物头部中,荧光信号显著增加 (图2A)。M14细胞移植后比较长的时间点才被检测到对应荧光(图2B)。脑内有EBV+ B细胞的小鼠表现出明显的中枢神经系统症状,包括癫痫发作、后肢无力-颤抖、步态异常和瘫痪。此外,总体中枢性神经系统疾病进展显著增加。重要的是,M14和MUN14在体外培养中的生长速度和荧光素酶的表达是相似的,这表明这种差异是在体内中枢神经系统中特异性存在的。
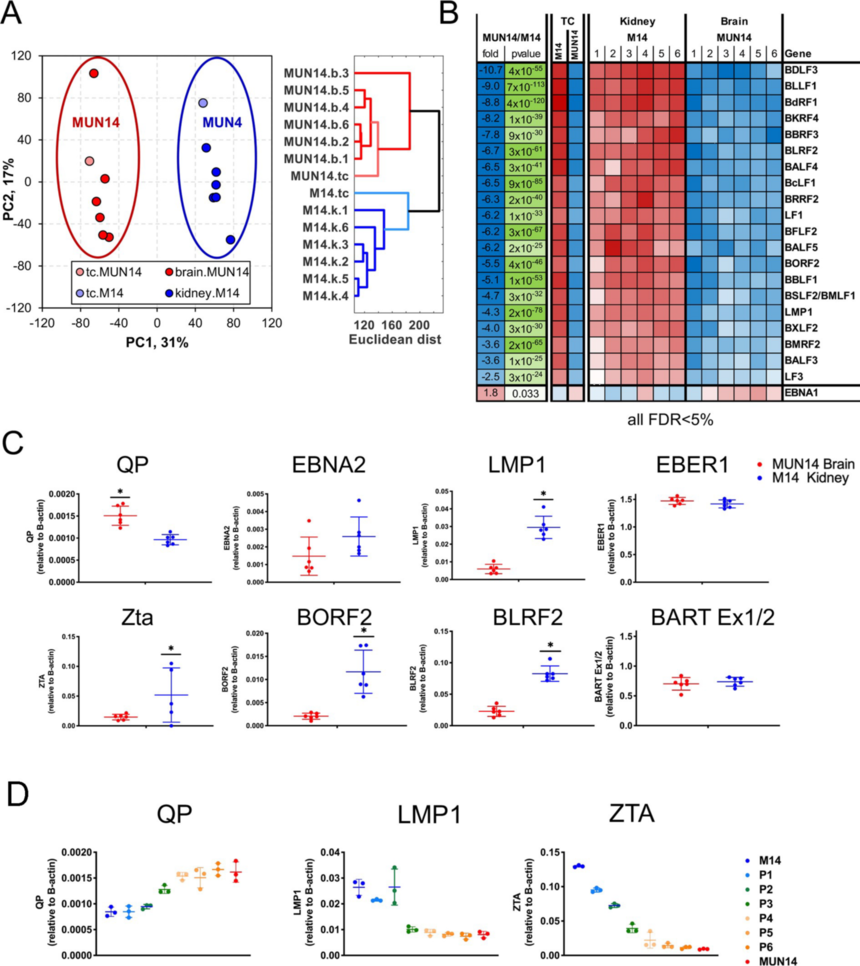
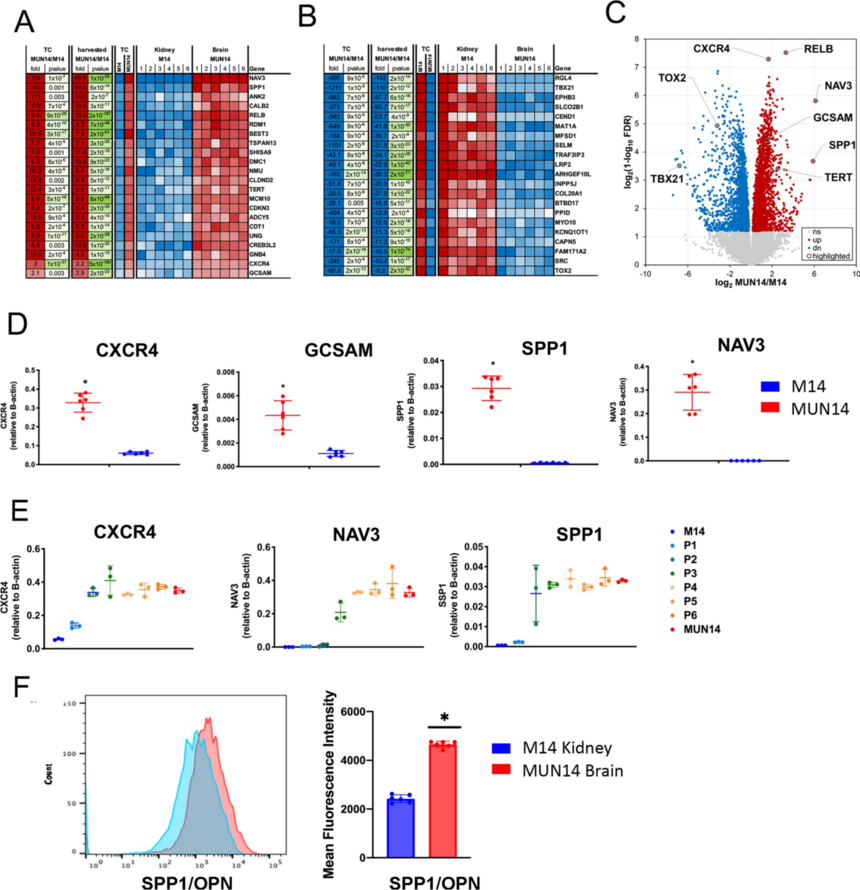
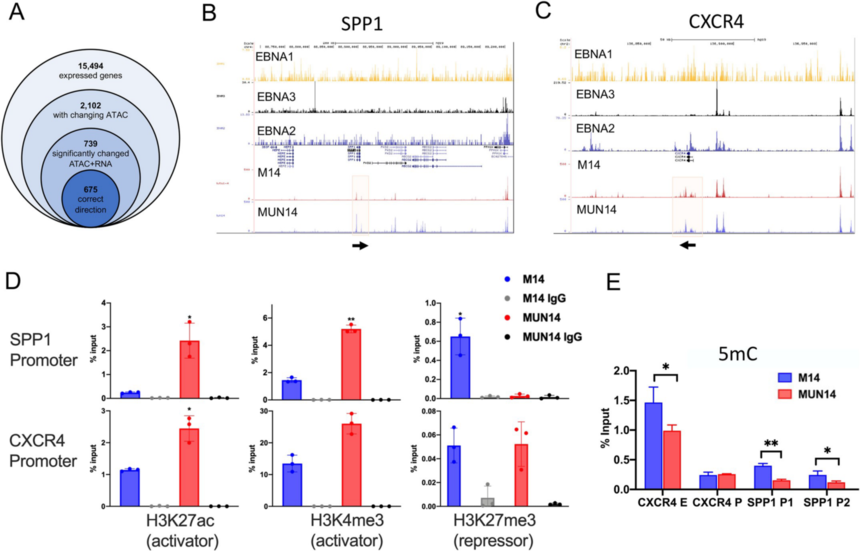
图2 MUN14系比亲本M14系具有更强神经侵袭性 3. 转录组分析具有神经侵袭性B细胞 为了深入解析EBV+B细胞神经侵袭和脑渗透的机制,作者使用RNA-seq分析了神经适应性MUN14的基因表达。比较了MUN14和M14在培养中的差异,以及直接从脑浸润细胞分离的MUN14和直接从肾脏分离的M14细胞的差异。作者选择肾脏浸润的M14细胞,因为肾脏是亲代M14细胞系的首选定植部位(图3A)。主成分分析(PCA)表明,6只动物脑组织中分离的M14细胞表达谱与组织培养中的MUN14聚集在一起,与肾和组织培养中分离的M14细胞表达谱差异更大。 为了确定病毒神经侵袭的潜在决定因素,作者比较了EBV基因的表达,发现大多数病毒基因在MUN14中下调,但EBNA1除外,其表达相对适度增加(图3B)。通过RT-PCR也验证了这一趋势(图3C),与M14相比,MUN14中EBNA2、LMP1、ZTA、BORF2和BLRF2的表达降低,而在MUN14中EBNA1 Q启动子(Qp)的表达升高。病毒基因表达的这种变化是在神经适应过程中逐渐发生的(图3D)。这表明,与亲本M14细胞系相比,神经适应性MUN14具有受限的EBV潜伏期(I型),表现出背景松弛的潜伏期(I/III型,泄漏)和裂解性转录。 为了确定神经侵袭的宿主细胞决定因素,作者比较了宿主基因的表达。基因表达热图(图4A/B)显示几个与中枢神经系统疾病相关的基因被鉴定出来,包括TSPAN13、RelB、SPP1和CXCR4。火山图显示,上调和下调基因分布相似,在脑源性MUN14中,TBX21和TOX2等T细胞调控基因下调(图4C)。通过对包括CXCR4、GCSAM、分泌磷酸化蛋白1 (SPP1)和NAV3在内的几个基因进行RT-PCR验证了RNA-Seq的结果(图4D)。这种变化在整个神经适应过程中是逐渐发生(图4E)。此外,这些转录变化在体外培养2个月的细胞中是稳定的。通过流式细胞术证实,与分别从脑和肾分离的M14细胞相比,MUN14中的SPP1/OPN表达上调(图4F)。
图3 RNA-seq分析神经侵袭性病毒主效因素
图4 RNASeq分析神经侵袭的宿主决定因素 4. MUN14神经适应的表观基础 为了确定表观遗传机制是否与关键基因的差异表达相关,作者对MUN14和M14细胞进行了ATAC-Seq分析。与转录组的联合分析确定了2102个RNA表达和ATAC信号都有显著变化的基因,其中739个基因显示出ATAC-Seq信号模式与RNA表达模式之间相关性(Pearson r>0.5)。其中675个可及性染色质差异区域相关联的675个基因被称为直接相关基因。作者在几个差异调控基因(包括SPP1和CXCR4)上观察到了ATAC-seq peak的定量及定性变化(图5B和5C)。作者还观察到EBV转录因子在CXCR4和SPP1基因的结合基序(图5B和5C)。CXCR4基因位点的ATAC-seq差异peak与EBNA2和EBNA3C ChIP-Seq peak重叠(图5C)。在MUN14细胞中,ATAC-Seq峰值在SPP1转录起始位点增加,但这些峰值与EBNA1、2或3C的ChIP-seq并不对应(图5B),表明细胞因子主要调节SPP1的上调。 为了确定组蛋白修饰是否可以解释CXCR4和SPP1基因的表达变化,作者用H3K27ac(激活标记)、H3Kme3(激活标记)和H3k27me3(抑制标记)的抗体对该区域进行了ChIP-qPCR检测。作者发现,相对于M14, SPP1和CXR4启动子区域在MUN14细胞中具有丰富的H3K27ac和H3K4me3的激活标记,与转录组中对应基因表达增加相关(图5D)。有趣的是,作者发现CXCR4启动子在M14中相对于MUN14对H3K27me3的抑制标记有所升高,这再次与转录差异相关。 综上所述,这些发现表明,神经适应性MUN14基因表达的变化与这些基因调控元件的表观遗传修饰有关,其中一些基因调控元件直接与病毒转录因子结合。为了进一步评估EBV基因在MUN14中表达的表观遗传修饰,作者利用MeDIP-qpcr技术对CXCR4启动子和增强子以及SSP1的两个启动子位点进行探究,研究了EBV裂解感染和潜伏期关键启动子的CpG甲基化情况(图5E)。作者观察到与M14相比,MUN14中CXCR4增强子和两个SSP1启动子区域的甲基化降低。这些数据表明,这些细胞系中CXCR4和SSP1的表观遗传调控差异与MUN14中观察到的CXCR4和SSP1/OPN的表达增加是一致的。
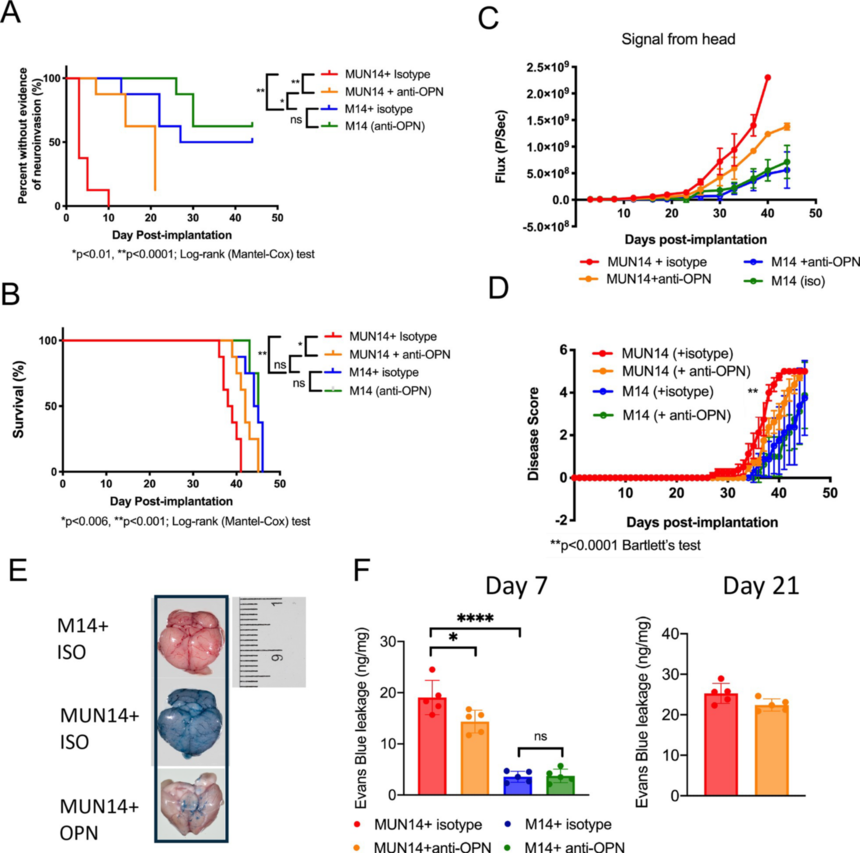
图5 MUN14与M14中关键基因染色质可及性差异及相关验证 5. 在B细胞神经侵袭中SPP1/OPN具有重要的功能 候选差异调节基因是否在功能上可促进EBV+ B细胞的神经侵袭,为了证实这一点,作者重点研究了SPP1/OPN基因,因为它具有可用于动物研究的明确中和抗体。因此,作者用OPN中和抗体以及同型对照治疗植入MUN14或M14的NSG小鼠。植入后,动物每三天接受一次抗OPN或同型对照治疗。作者发现,与MUN14同型处理的对照动物相比,抗OPN抗体延迟了神经侵袭时间(图6A),增加了存活率(图6B),降低了中枢神经系统细胞的生长(图6C)。此外,经抗OPN中和抗体处理的MUN14移植动物的临床病程明显改善(图6D)。Evans蓝色染色显示MUN14移植动物有着广泛的血脑屏障穿透性,抗OPN治疗也降低了这种穿透性(图6E和6F)。这些发现表明,OPN/SPP1有增强EBV+ b细胞的神经侵袭表型,并且其他宿主因子也必须对于MUN14细胞的全神经侵袭有所协助。
图6特异性OPN中和抗体可减弱MUN14的神经侵袭
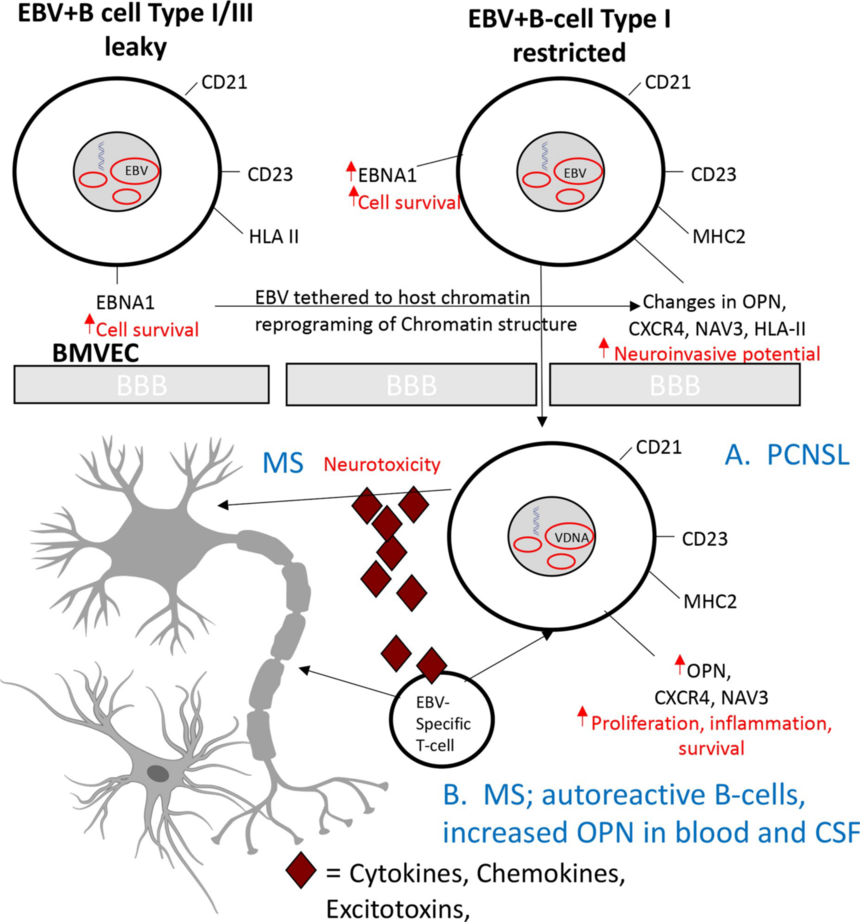
表观遗传景观变化改变了EBV+ B细胞中病毒和宿主基因的表达,导致SPP1/ OPN、CXCR4和NAV3表达增加的神经侵袭表型。具有致癌潜能的B细胞的神经侵袭增加导致了PCNSL (图 7A),而自身反应性和炎症性B细胞的浸润可能导致了MS (图 7B)。作者的研究表明,除了在MS中诱导炎症和促进T细胞分化的作用外,OPN可能在促进EBV+和潜在的自身反应性B细胞的神经侵袭中发挥重要作用。此外,EBNA1表达的增加和EBV潜伏期的明显限制表明,EBV/EBNA1可能通过与宿主染色质结合来驱动观察到的表观遗传变化,从而促进染色质结构和细胞转录的整体重编程。
图7 理论模型:EBV+b细胞的表观遗传重编程有助于神经侵袭和中枢神经系统疾病 文献链接:https://doi.org/10.1371/journal.ppat.1009618 了 解 更 多 { 往 期 精 彩 回 顾 } |