NEWS
新闻资讯
|
喜讯!Redox Biology(IF: 10.787)发表AMPK/FoxO3信号通路的应激调节可抑制线粒体相关的铁死亡
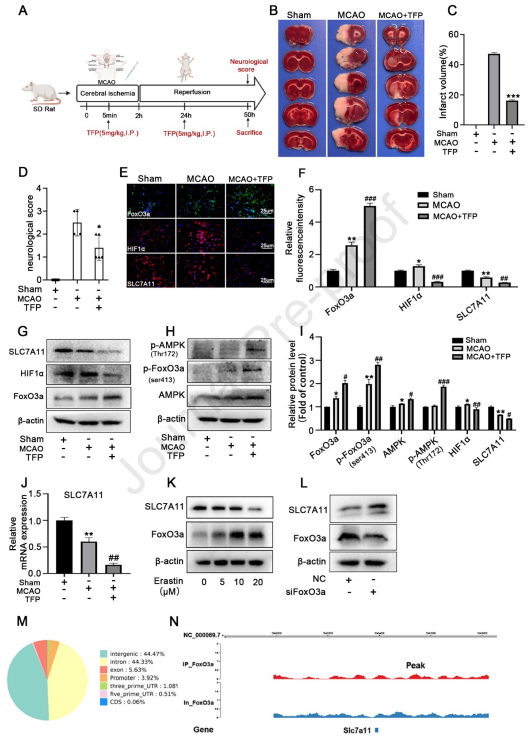
近日,Redox Biology(IF: 10.787)在线发表北京大学深圳医院/江西中医药大学题为“Energy stress modulation of AMPK/FoxO3 signaling inhibits mitochondriaassociated ferroptosis”的研究论文。该研究发现FoxO3a激活剂三氟拉嗪(TFP)(一种经FDA批准的抗精神病药物),可以通过AMPK/FoxO3a/HIF-1α/SLC7A11信号通路和线粒体依赖机制减少大鼠铁死亡相关的缺血—再灌注损伤。爱基百客为该研究提供ChIP-seq的技术支持。  内容速递 铁死亡是与各种人类疾病相关的细胞死亡的主要机制,如缺血/再灌注损伤(IRI)、脑损伤和癌症。FoxO3a是一种在细胞代谢、线粒体功能障碍和氧化应激反应中发挥重要作用的转录因子。尽管AMPK/FoxO3a信号通路在能量应激条件下维持能量稳态中起着关键作用,但该信号通路在线粒体相关铁死亡的作用尚未被完全阐明。 FoxO3a激活可阻断缺氧后的ROS水平的增加,并抑制HIF-1αmRNA。研究员们发现在大鼠用TFP处理后,会诱导FoxO3a的激活,伴随着HIF-1α诱导的停止。组织学分析显示,CIR(脑缺血再灌注)阻断了SLC7A11的表达,而TFP有效地增强了CIR诱导的SLC7A11的下调。Western-blot和qRT-PCR进一步证实了这一观察结果。为进一步探究FoxO3a在SLC7A11调控中的作用,研究员们使用不同剂量的erastin刺激BV-2细胞24小时。Western blot分析显示,FoxO3a表达增加,而SLC7A11表达降低,且呈剂量依赖性。研究员用特异性siRNA转染BV-2细胞,用来抑制FoxO3a的表达。FoxO3a的敲除显著减少了SLC7A11的基础水平。 研究员们进一步利用ChIP-seq获取FoxO3a结合的DNA区域。在这些结合区,42.41%位于内含子区,37.96%位于染色体基因间区,11.16%位于外显子区,5.37%位于这些基因的启动子区,1.97%和1.11%分别位于5’UTF和3’UTR区;0.01%位于基因的CDS区域。研究员们发现有2个peak位于SLC7A11的启动子区域。这些结果表明,与SLC7A11启动子结合的FoxO3a抑制了其表达。
图:TFP通过AMPK /FoxO3a/Hif1α通路对大鼠CIR损伤起保护作用 论文链接:https://doi.org/10.1016/j.redox.2023.102760
了 解 更 多 { 往 期 精 彩 回 顾 } |