NEWS
新闻资讯
|
Nature immunology | scRNA-seq揭示胶质母细胞瘤进展过程中免疫景观演变
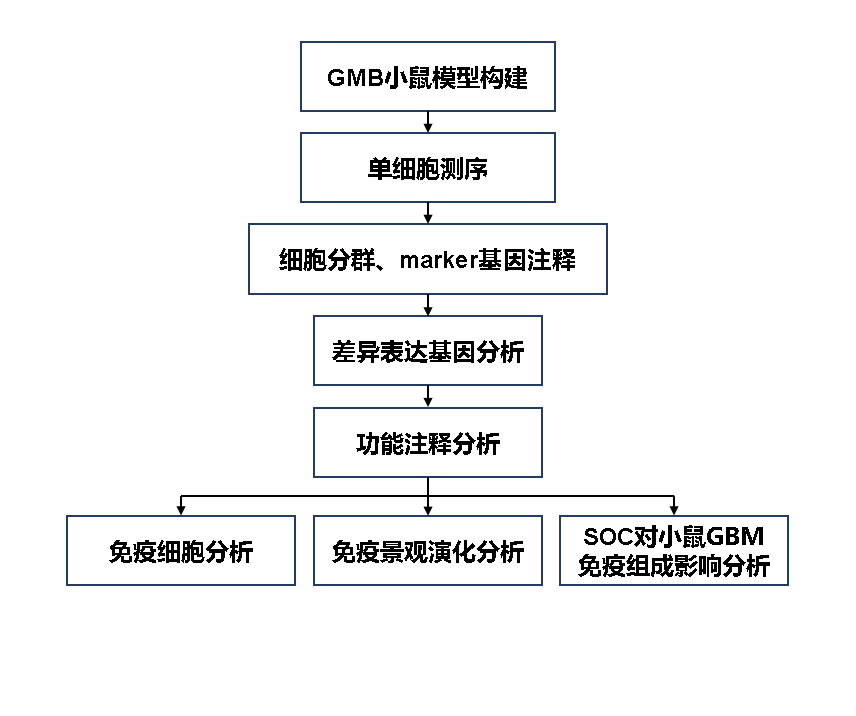
发表单位:哈佛医学院 期 刊:Nature immunology(IF:30.5) 发表日期:2022年5月 2022年哈佛医学院的Vassiliki A. Boussiotis和AI Charest研究团队在期刊Nature immunology(IF:30.5)发表了题为“Single-cell RNA sequencing reveals evolution of immune landscape during glioblastoma progression”的研究论文。该研究利用scRNA-seq技术研究了单细胞分辨率下小鼠GBMs的免疫和非免疫组成,并对起始和进展过程中的人群进行了纵向分析,为GBM治疗的研究提供了潜在的细胞和分子靶点。 01 研究背景 胶质母细胞瘤(GBM)是一种无法治愈的原发性恶性脑癌,具有较高的基因组和细胞异质性,现今缺乏有效治疗方法。深入了解GBM细胞与其免疫微环境之间的相互作用至关重要,而目前缺乏该方面的知识。该研究结果建立了GBM的免疫抑制特征,并为GBM治疗干预的研究提供了更深入的资源。 02 研究思路
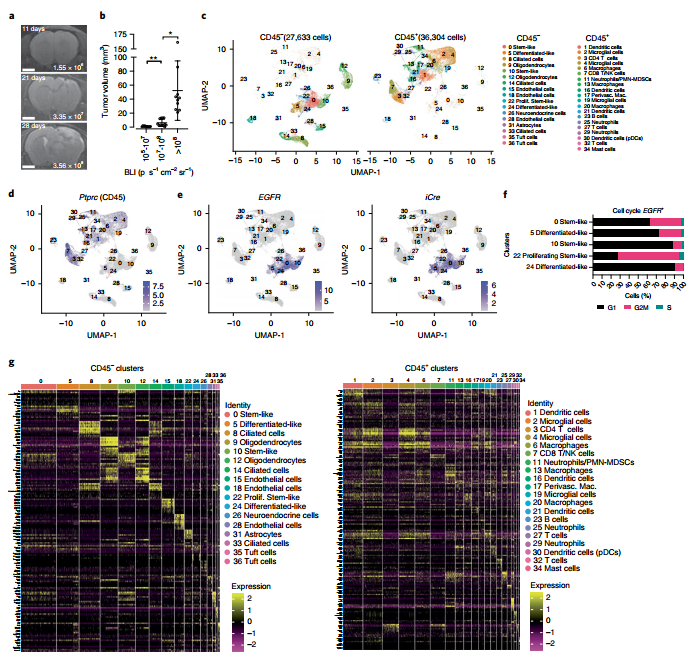
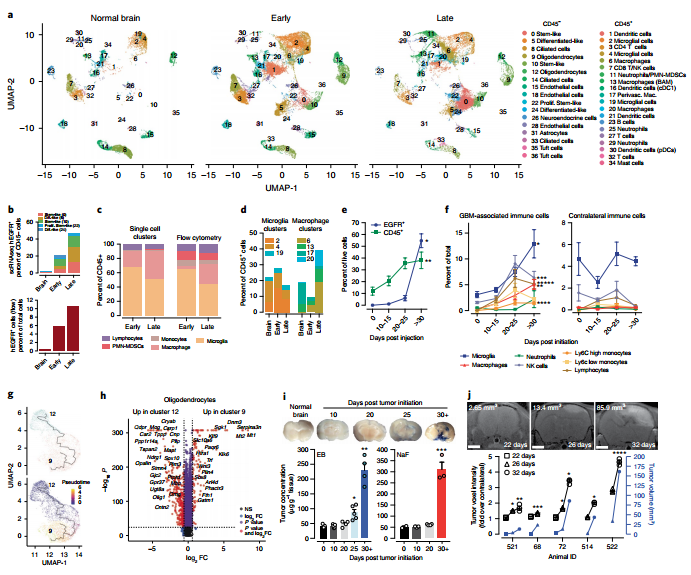
03 研究背景 1. scRNA-seq识别GBM中的肿瘤细胞、基质细胞和免疫细胞 作者首先明确了GBM中的细胞类型。通过构建GBM小鼠模型,使用Cre慢病毒颅内注射GBM造模和生物发光成像(BLI)监测GBM生长状况(图1.a和b)。对GBM进行scRNA-seq区分CD45−(肿瘤或非免疫细胞)和CD45+(免疫细胞)簇(图1.c)。其中Ptprc (Cd45)局限于CD45+分类(图1.d),EGFR和iCre簇为肿瘤细胞(图1.e)。作者采用Johnson-Verhaak命名法标记EGFR+肿瘤簇(图1.c和f),簇22(增殖干细胞样细胞)为增殖能力最强的细胞(图1.f)。 根据已知标记基因,对每个混合群体进行分簇(图1.g)。结果包含4簇树突状细胞(DCs,1、16、21、30),4簇巨噬细胞(6、13、17、20),3簇小胶质细胞 (2、4、19),3簇中性粒细胞 (11、25、29)等细胞分群。
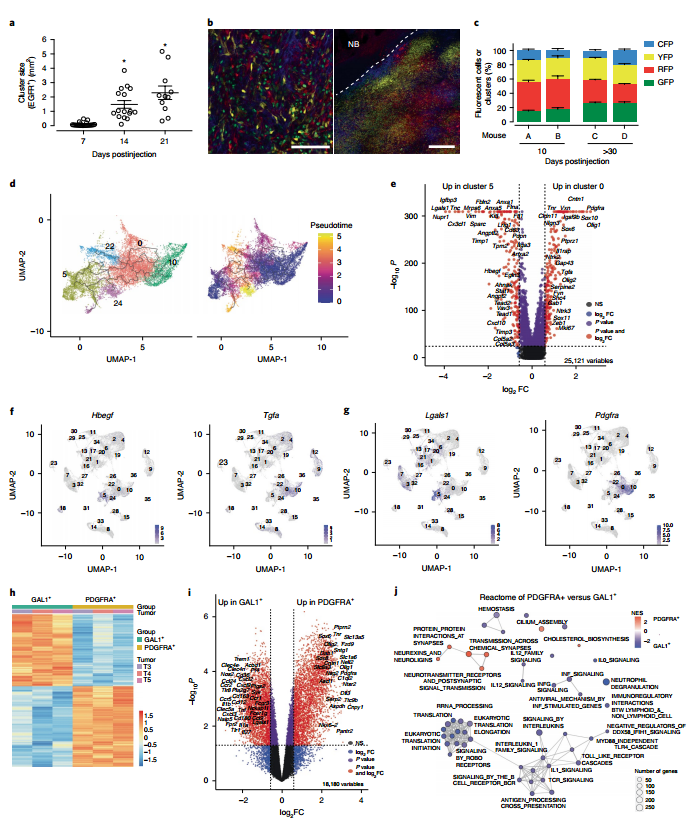
图1. scRNA-seq鉴定GBM中的CD45–和CD45+细胞群。 2. 转录不同的EGFR+细胞区域化 为了确定5个转录组不同的EGFR+肿瘤细胞簇。作者进行EGFR+细胞数量和面积统计,结果表明随着时间的推移,从多个EGFR+ 单细胞到小的独立簇到单个可观察量的进展(图2.a)。利用荧光素酶报告基因检测技术对GBMs进行谱系追踪发现多克隆存在于不同时期肿瘤中(图2.b和c)。拟时序分析表明,簇10细胞产生了簇0、22和24细胞,簇5细胞为独立起源(图2.a)。 为了更好地理解驱动干细胞样细胞(0、10)与分化样细胞(5、24)分离的分子基础。作者进行了差异表达基因(DEGs)鉴定(图2.e),分析表明簇5中,INFα/β/γ、细胞迁移和血管生成有关通路显著上调;簇0中,少突胶质细胞分化、髓鞘形成和细胞粘附相关通路显著上调。簇22中细胞的高增殖指数表现为纺锤体组织、有丝分裂细胞分裂、染色体分离和细胞分裂(图1.g)。簇0/10细胞增加了Tgfα的表达,簇5/24细胞增加了Hbegf的表达(图2.e和f)。此外,在神经内分泌细胞、小胶质细胞和CD4+ T细胞中检测到其他EGFR配体。集群0/10和集群5的细胞中差异表达最多的基因分别是Pdgfra和Lgals1(Gal1)(图2.e和g)。GBMs DEGs的GO分析表明PDGFRA -细胞与GAL1+细胞相似,富含中性粒细胞趋化、炎症和免疫反应基因。PDGFRA+群体中表达上调的基因涉及少突胶质细胞分化 (图2.i)。EGFR+PDGFRA+和EGFR+GAL1+细胞之间的DEGs分析显示,EGFR+GAL1+样本中淋巴细胞和非淋巴细胞相互作用的翻译机制、Il-1信号调节、免疫调节以及神经元系统、突触功能和EGFR+PDGFRA+细胞突触蛋白相互作用上调(图2.j)。
图2. GBM由转录本不同的EGFR+癌细胞群组成。 3. GBMs具有大量增殖小胶质细胞并且显示促炎特性 小胶质细胞在正常大脑中的自我更新能力有限。作者推测GBM中的3簇小胶质细胞可能代表了一种功能分类。细胞周期基因检测表明簇19具有更高水平的G2M和S期细胞周期基因(图3.a)。EdU标记实验和流式细胞术结果表明EdU+小胶质细胞的增加和GBM中小胶质细胞的组织特异性(图3.b)。流式细胞术分析肿瘤瘤床和侧脑显示,GBM进展过程中只有肿瘤小胶质细胞的总数和Ki67+小胶质细胞细胞增加(图3.c和d)。 使用流式细胞术分离小鼠GBM晚期的EdU+和EdU-小胶质细胞、对侧GBM小胶质细胞、正常脑小胶质细胞和GBM巨噬细胞并进行bulk RNAseq(图3.e和f),结果表明EdU+小胶质细胞上调基因与有丝分裂胞质分裂、细胞分裂和细胞循环有关,EdU-小胶质细胞表达基因与炎症反应、先天免疫反应、细胞因子反应、白细胞介素-1(IL-1))细胞反应和核因子kB (NF-kB)转录因子活性负调控相关(图3.g)。Spearman相关性分析表明GBM中循环小胶质细胞与非循环小胶质细胞的转录组不同,后者与促炎极化有关(图3.f)。 转录组数据比对表明远离GBM肿瘤瘤床的小胶质细胞被显著激活,GBM的存在刺激了远处的小胶质细胞(图3.h)。同时,拟时序分析和典型小胶质细胞标志物(P2ry12、Tmem119)在簇4中的高表达表明小胶质细胞簇中簇4产生簇2(图3.j和i)。此外,EdU+和EdU-转录组Reactome富集分析表明EdU+细胞的有丝分裂、抗原加工和递呈特性以及EdU-细胞的IL-1信号传导(图3.k)。 此外,差异表达基因鉴定小胶质细胞簇4表达与吞噬正调控基因、促炎标志激活标志物、并保留参与趋化基因的表达。与簇2相比,簇4是一个更活跃的吞噬小胶质细胞群体(图3.i)。簇19则富含核糖体小单位组装和生物发生基因(意义不明)。 综上所述,GBM肿瘤微环境(TME)中的一个小胶质细胞亚群通过增殖和促炎程序对肿瘤做出反应。
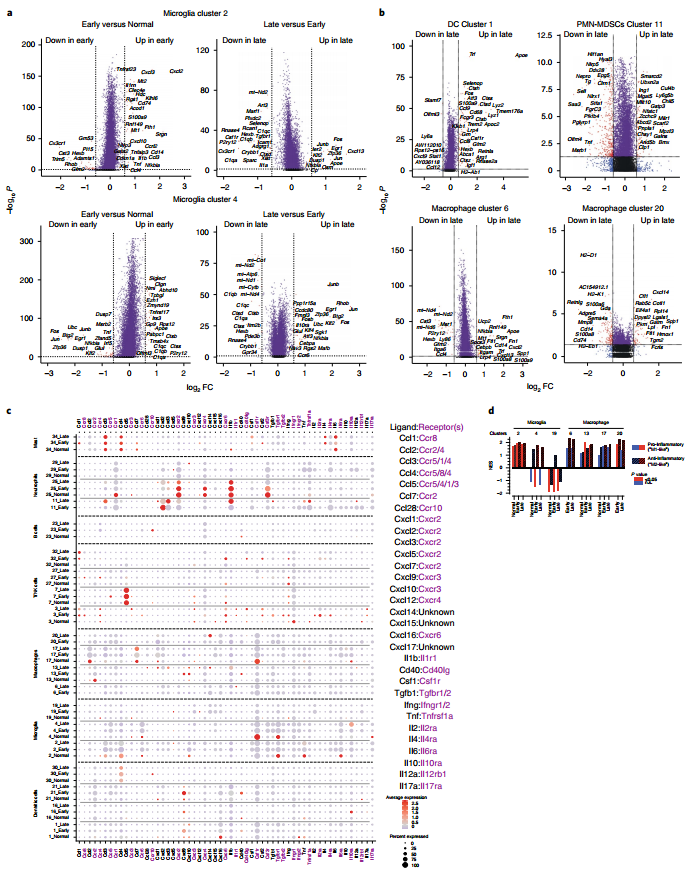
图3. 增殖性小胶质细胞存在于EGFR GBMs。 4. 大多数GBM细胞因子来源于瘤内免疫细胞 作者对GBMs的CD45−和CD45+中的32个细胞因子进行RTqPCR和scRNA-seq,结果表明大多数细胞因子(22/32)的表达富集于CD45+细胞(图4.a和b)。多数细胞因子受体也在CD45+细胞群中表达(图4.c)。此外,Cxcl12水平在CD45−内皮细胞中较高(图4.a,b和e),而其受体Cxcr4在T细胞、NK细胞、B细胞、中性粒细胞、巨噬细胞和DCs上表达(图4b,e),这可能反映了内皮细胞和几种免疫细胞之间未知的旁分泌回路。 这一结果强化了大多数肿瘤内细胞因子及其受体在CD45+细胞群中表达更多,在癌细胞中表达更少的观点。 5. 免疫检查点在GBMs CD45+细胞中的表达 大多数检查点转录本在CD45+细胞中表达,主要在T细胞和髓细胞中表达(图4.f)。PD-1(Pdcd1)转录本仅在T细胞簇中观察到(图4.g),而PD-L1(Cd274)转录本在中性粒细胞、DCs和巨噬细胞中富集,PD-L2(Pdcd1lg2)在DCs中富集(图4.f和g)。作者在小胶质细胞群体中鉴定并验证了VISTA(Vsir)的转录水平,发现Ceacam1和Galactin9 (Lgals9)两种TIM-3配体在CD45+细胞群体中升高(图4.f)。 这些结果表明检查点受体不仅存在于T细胞,还存在于先天免疫细胞上,并且其配体主要在非癌细胞中表达。
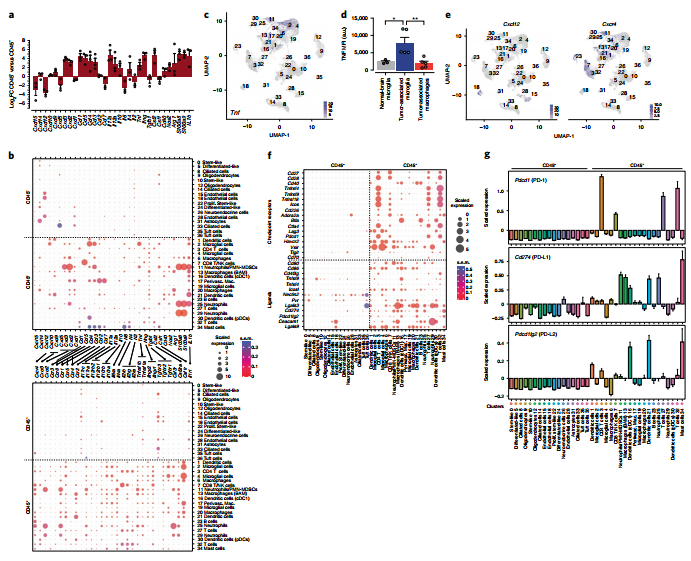
图4. 细胞因子、检查点受体及其配体主要在CD45 + 区室中表达。 6. GBM TME在肿瘤进展过程中的纵向演变 为了揭示GBM TME随时间的细胞和分子变化。作者对正常大脑、早期、晚期的GBM进行了分析,结果表明EGFR+在GBMs早期和晚期显著增加(图5.a和b)。流式细胞术分析细胞类型构成,发现早期GBMs中主要由小胶质细胞组成,晚期GBMs中巨噬细胞的浸润增加(图5.c和d)。EGFR+细胞在25天后呈现爆炸性生长扩张直到死亡晚期,CD45+细胞在肿瘤发展过程中积累(图5.e)。此外,侧脑组织中未检测到巨噬细胞、PMN-MDSCs、淋巴细胞、单核细胞和NK细胞随时间的增加,这表明这些独特的细胞动力学局限于TME(图5.f)。 GBM特有细胞簇包含少突胶质细胞(9)、纤毛细胞(33)、巨噬细胞(6,20)和中性粒细胞/ PMN-MDSCs(11)(图5.a)。拟时序分析表明簇9来源于簇12(图5.g),并且簇9优先表达于有氧呼吸,高氧反应,ATP生物合成调节,胰岛素刺激细胞反应和细胞周期调节,表明新生的少突胶质细胞能量需求发生变化(图5.h)。 7. 巨噬细胞和PMN-MDSCs的浸润与血脑屏障渗漏相似 作者猜测巨噬细胞(6,20)、PMN-MDSCs(11)和EGFR+细胞在GBM进展后期的显著增加可能反映了血脑屏障(BBB)的破坏。为了验证这一猜测,作者通过对肿瘤发生后不同时间点静脉注射Evans Blue(EB)和荧光素钠(NaF)来评估血脑屏障的完整性(图5.i),结果表明肿瘤发生后26至32天血脑屏障渗漏(图5.j)。总而言之,BBB的完整性保持到肿瘤发展的最后阶段,这与免疫抑制细胞进入GBM的时间一致。
图5. 随着时间的推移免疫细胞浸润的动力学。 8. GBM进展过程中先天免疫的变化和免疫抑制细胞的招募 与正常大脑相比,小胶质细胞簇2在早期GBM中获得了促炎标志物、中性粒细胞趋化表达,以及对吞噬正反应(图6.a),这表明早期GBM激活了小胶质细胞(2)的炎症反应。晚期GBM,Cxcl13和即早期基因(IEGs)的表达增加(图6.a)。早期GBM小胶质细胞(4)表现出补体基因和脂蛋白分解代谢过程的表达增加,晚期GBM中参与线粒体电子传递、atp合成耦合电子传递和有氧呼吸的基因表达缺失。这表明小胶质细胞(4)在GBM进展过程中能量使用的变化。GBM发展过程中,BAM(13)获得了中性粒细胞趋化、血管生成和炎症反应相关基因的表达。 为了确定免疫细胞被招募到GBM TME的分子机制。作者分析了晚期和早期GBMs之间的DEGs,结果表明巨噬细胞 (6,20)中,参与炎症反应、中性粒细胞趋化和聚集以及血管生成和代谢过程负调控的基因表达增加;DC(1)中,MHCII和白细胞趋化性调节抗原加工和递呈基因增加;PMN-MDSCs中(11),NFAT信号传导和细胞对缺氧反应基因上调,表征炎症反应和T细胞增殖调节的基因下调(图6.b)。此外,巨噬细胞(17,13)中细胞因子受体Ccl2和Ccr2转录本减少(图6.c),表明血管周围巨噬细胞与正常大脑中其他BAMs之间存在细胞因子关系。PMN-MDSCs(11)在GBM早期比晚期表达更多的Cxcl2和更少的Cxcl3,其受体Cxcr2的表达在中性粒细胞中最高(25)(图6.c),可能反映了在GBM进展过程中Cxcr2配体使用的开关。Il1b在PMN-MDSCs(11)和中性粒细胞(25)及其在内皮细胞上的受体(18,28)(图6.c和图4.c)中的高表达,表明在GBM中粒细胞和内皮细胞之间存在功能相互作用。此外,对小胶质细胞和巨噬细胞簇GSEA检测显示,小胶质细胞(4)在早期和晚期GBMs中优先显示出致瘤富集评分(NES)(图6.d)。 综上所述,小胶质细胞和BAM在肿瘤生长早期采用促炎免疫微环境,而这种微环境在GBM进展过程中丢失。
图6. 随着时间的推移巨噬细胞和小胶质细胞促炎极化的丧失。 9. 骨髓(BM)在胶质瘤形成早期发生改变 在肿瘤驱动紧急BM形成过程中,BM髓系祖细胞产生MDSCs。GBM流式细胞术表明GBM显著增加造血祖细胞LSK和LK,LK群体中的粒细胞/单核细胞祖细胞的比例增加最大(图7.a)。此外,GBM小鼠CTLA-4的表达升高,表明全身T细胞显著增加(图7.a和b)。这表明GBM诱导紧急造血,具有显著的全身免疫抑制作用。 10. TMZ消耗BM产生的GMP,影响PMN-MDSCs、巨噬细胞和小胶质细胞 为了明确标准治疗(SOC)对GBM免疫微环境的影响。作者通过流式细胞术分析TMZ处理的小鼠脑、BM和脾脏免疫细胞,发现66.67mgkg-1TMZ(放射后辅助治疗剂量)处理中BAMs显著下降,25 mgkg-1TMZ(IR/TMZ SOC剂量)在TMZ停止24小时后,BAMs有下降趋势,小胶质细胞数量不变。TMZ处理呈现出显著的GMPs消耗,治疗停止后1周完全恢复,普通髓系祖细胞(CMP)水平不变。综上所述BAMs对TMZ短暂敏感,GMPs对TMZ长时间敏感。 66.67mgkg-1 TMZ延长GBM小鼠14天生存期(图7.c)。流式细胞术分析表明高剂量(66.7mg kg- 1)TMZ处理是GBM小鼠的小胶质细胞增加,巨噬细胞减少,PMN-MDSC群体减少(图7.d)。TMZ处理的CD45+细胞和脾MDSCs的相对数量无统计学差异(图7.d)。作者认为TMZ治疗后肿瘤PMN-MDSCs的减少可能源于TME的募集不足,TMZ除了直接抗癌外,高剂量TMZ可能通过增加小胶质细胞、减少PMN-MDSCs、巨噬细胞的抑制性群体来促进促炎表型。但是,免疫微环境中的TMZ介导不足以诱导肿瘤清除,这表明其缺乏适应性反应和耐药机制。 11. IR/TMZ治疗促进效应CD8 T细胞和存活 为了明确SOC对GBM免疫微环境的影响。SOC 2 周后的流式细胞术和生存率监测表明每日分段放疗(10×2Gy)、IR、IR /TMZ显著延长生存期(图7.e)。IR和IR/TMZ增加了GranzymeB+CD8+细胞数量、降低EGFR+癌细胞和CD45+数量、降低BLI输出(图7.f)。这表明IR诱导癌细胞死亡,GranzymeB+CD8+ T细胞的积累可能是延长生存期的原因。这些效用随着TREG增加,这可能解释了SOC治疗提供的短暂治疗益处(图7.f)。
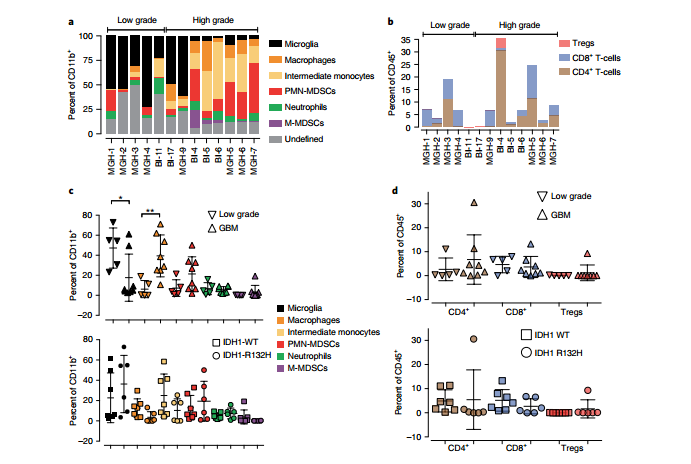
图7. TMZ和辐射改变GBM免疫微环境,延长生存期。 12. 低级别和高级别胶质瘤患者免疫异质性。 早期GBM无症状,确诊即晚期。CD45+和CD11b+细胞的相对数量在低级别和GBM肿瘤中相似。早期GBM和晚期GBM流式细胞术分析表明低级别GBM中小胶质细胞数量高于GBMs,GBMs则具有更高数量的PMN-MDSCs、中间单核细胞和巨噬细胞(图8.a-d)。性别、解剖位置和IDH1突变状态与差异无关(图8.c和d)。
图8.低度恶性胶质瘤和恶性胶质瘤患者的免疫异质性。 GBM是一种侵袭性的、普遍致命的原发性脑瘤。本研究通过流式细胞术分析确定GBM在疾病发展的各个阶段和SOC治疗期间的免疫细胞景观。实验表明随着GBM的发展,GBM中小胶质细胞群体特异性表达,其中一个小胶质细胞亚群通过增殖和促炎程序对肿瘤做出反应。终晚期肿瘤中,发现抗炎巨噬细胞和致瘤性髓源性抑制细胞亚群,这一进化过程与血脑屏障的破坏和EGFR+ GBM细胞的广泛生长相似。此外,SOC中IR/TMZ治疗能够通过促进效应CD8T细胞功能,提高生存期。该研究结果为GBM发生和发展过程中免疫和非免疫细胞的动力学提供了独特的视角,并指出了治疗开发的新领域。 原文链接:https://rdcu.be/dhLC1
市场部小助理,项目咨询 爱基百客先后引10xGenomics、SeekOne®DD和MobiNova®-100单细胞平台,可以提供单细胞转录组、单细胞免疫组库、单细胞全序列转录组以及单细胞ChIP-seq等技术服务,可以提供方案设计-细胞解离-测序-分析-验证一站式服务,项目文章发表在J Hematol Oncol、Genome Bio和Protein&Cell等高水平期刊。 爱基百客提供领先表观组学技术服务,具有丰富表观组学项目经验。现今重磅推出组蛋白修饰研究新产品——单细胞ChIP-seq!爱基百客引进商业化的MobiNova®-100平台,提供全新单细胞ChIP-seq解决方案。单细胞ChIP具有商业化6大常用抗体,满足绝大部分科研需求,可提供高质量数据信息,捕获更多单细胞水平组蛋白修饰信息,从而助力肿瘤、疾病、发育等多方面科学研究。此外,新品推出,个性化分析免费送,有相关需求的老师欢迎咨询区域销售。
了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |