NEWS
新闻资讯
|
Cell Metabolism(IF:29)如何用“糖酵解+乳酸化”两大国自然热点讲好故事,看看这篇文章乳酸与Warburg 效应(有氧糖酵解)高度相关,另外它也参与调控肿瘤、心血管系统、呼吸系统、消化系统、泌尿系统等多个疾病,在疾病的临床诊断和预后中起着重要的作用。因此,自组蛋白乳酸化发现以来,相关高质量文章不断涌现。乳酸化相关的国自然基金资助项目不断变多,已成为科学研究的热点。
与乳酸相关的疾病 糖酵解是代谢的重要途径,它几乎发生在所有的活细胞中,是生物体获取能量的基本途径。乳酸主要的生成途径依赖于糖酵解,而近些年研究发现乳酸化修饰水平与细胞内糖酵解强度呈正相关。糖酵解途径中有3个关键的酶:己糖激酶、磷酸果糖激酶和丙酮酸激酶。糖酵解和乳酸化都是国自然热点,如何将它们联合起来开展研究,看看我们今天分享的一篇肝纤维化的文章。 HK2(己糖激酶2)诱导的乳酸促进组蛋白乳酸化,从而控制星状细胞的激活并导致肝纤维化。星状细胞特异性或全身缺失HK2来抑制H3K18la可以减轻星状细胞的激活和肝纤维化。
己糖激酶2介导的组蛋白乳酸化基因表达是肝星状细胞活化和肝纤维化所必需的 2023年8月8日,伊利诺伊大学芝加哥分校的Nissim Hay团队在期刊Cell Metabolism(IF:29)发表文章《Hexokinase 2-mediated gene expression via histone lactylation is required for hepatic stellate cell activation and liver fibrosis》。该研究利用CUT&Tag、ChIP-qPCR和RNA-seq等技术研究肝星状细胞活化和肝纤维化中己糖激酶和组蛋白乳酸化H3K18la的调控机制。HSC(肝星状细胞)特异性或全身HK2缺失抑制星状细胞活化和肝纤维化,推测HK2可能是肝纤维化的有效靶点。
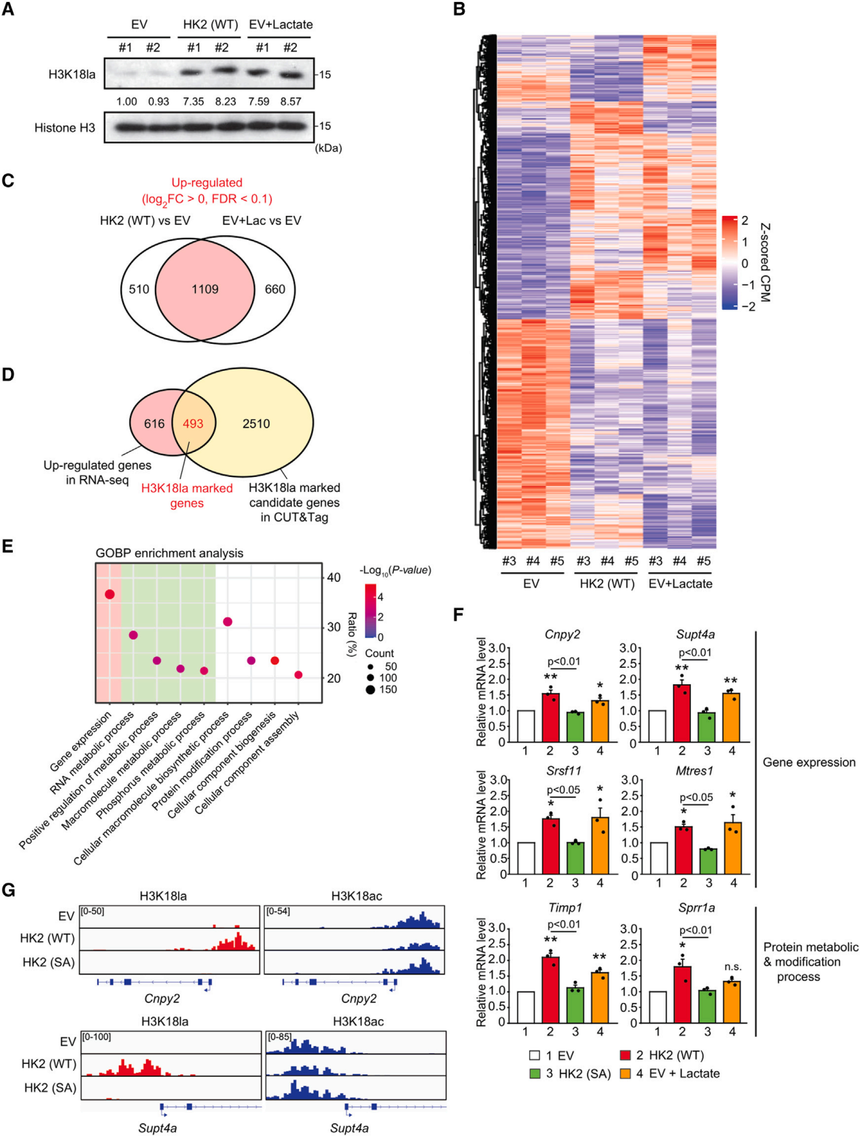
研究单位:伊利诺伊大学芝加哥分校 研究技术:CUT&Tag、ChIP-qPCR和RNA-seq(爱基百客均可提供) 01 研究背景 己糖激酶(HK)通过磷酸化葡萄糖产生葡萄糖-6-磷酸来催化葡萄糖代谢的第一步。糖酵解增殖细胞,如癌细胞,即使在有氧条件下利用HK2的表达来加速葡萄糖代谢。由HK2介导的代谢改变引起的乳酸的影响在很大程度上尚不清楚。 02 研究结果 1. HK2的催化活性诱导组蛋白乳酰化,但不诱导组蛋白乙酰化为了探讨HK2的表达及其在组蛋白乳化中的催化活性,研究选择了MI5-4 CHO细胞作为研究对象,该细胞没有检测到HK基因表达,且HK活性有限。在这些细胞中表达野生型(WT)HK2或激酶-死亡突变体(SA)HK2。WT和SA HK2在MI5-4 CHO细胞中表达水平相同。用海马代谢生物分析仪测定细胞外酸化率(ECAR),结果显示只有WT HK2细胞的糖酵解活性显著增加。WT HK2细胞的糖酵解活性也能显著诱导乳酸生成和细胞乳酸水平。 为了确定HK2诱导的乳酸产生是否促进细胞中的组蛋白乳酸化,作者检测了组蛋白H3赖氨酸18(H3K18la)上的乳酸化。这个赖氨酸残基也能被乙酰化(H3K18ac)。H3K18la在空载体(EV)和SA HK2细胞中几乎无法检测到,但在WT HK2细胞中高度升高,而H3K18ac无论HK2表达如何均可检测到,而在WT HK2细胞中略有降低(图1E)。除H3K18la外,研究发现H3K9la、H3K14la、H4K8la和H4K12la也仅在WT HK2细胞中升高。 为了进一步阐明H3K18la和H3K18ac的潜在功能意义,作者接下来进行了CUT&Tag。对H3K18la和H3K18ac的全基因组分布进行分析,发现这两种组蛋白修饰均主要位于启动子区域(<3 kb)。与免疫印迹实验结果一致,作者还观察到,在WT HK2中,H3K18la峰在转录起始位点(TSSs)附近增加,而H3K18ac峰没有增加,甚至略有下降(图1G)。 为了确定受H3K18la和H3K18ac调控的潜在候选基因,作者首先比较了相同基因启动子区域的这些组蛋白修饰水平。在WT HK2细胞中,大多数基因的H3K18la增加,而H3K18ac没有任何显著的诱导。只有在WT HK2细胞中,没有一个基因的H3K18ac增加。因此,虽然通过增加糖酵解,HK2的表达可以增加乳酸和乙酰辅酶a的水平,但它只影响组蛋白乳酸化。
图1:HK2的表达诱导MI5-4 CHO细胞的糖酵解、乳酸生成和组蛋白乳酸化 2. H3K18la标记基因参与调控基因表达和各种代谢过程为了研究HK2的表达和乳酸如何通过组蛋白乳酸化影响整体基因的表达,作者首先通过外源性乳酸处理优化组蛋白乳酸化水平。研究发现,10 mM乳酸处理24 h后,EV细胞诱导的H3K18la水平与WT HK2细胞相当。随后,作者进行了RNA测序(RNA-seq),以比较对照细胞(EV)、WT HK2细胞和经乳酸处理的对照细胞(EV + Lac)的转录组。差异基因分析显示外源乳酸处理改变基因表达,其模式与在WT HK2细胞中观察到的模式相似。 作者鉴定了493个基因在HK2和乳酸处理下均上调的基因,这些基因的启动子区域也被H3K18la标记(图2D)。GOBP分析H3K18标记的基因参与了基因表达、RNA和蛋白质代谢过程以及蛋白质修饰过程的调控(图2E)。此外,在所选基因的启动子上验证了H3K18la和H3K18ac的峰,在WT HK2细胞中发现H3K18la峰显著增加,H3K18ac峰略有下降(图2G)。另外,作者还构建了可诱导HK2的细胞,根据ECAR和耗氧率(OCR)结果证明HK2的表达提高了糖酵解活性和乳酸产量,从而通过H3K18la影响基因的表达。
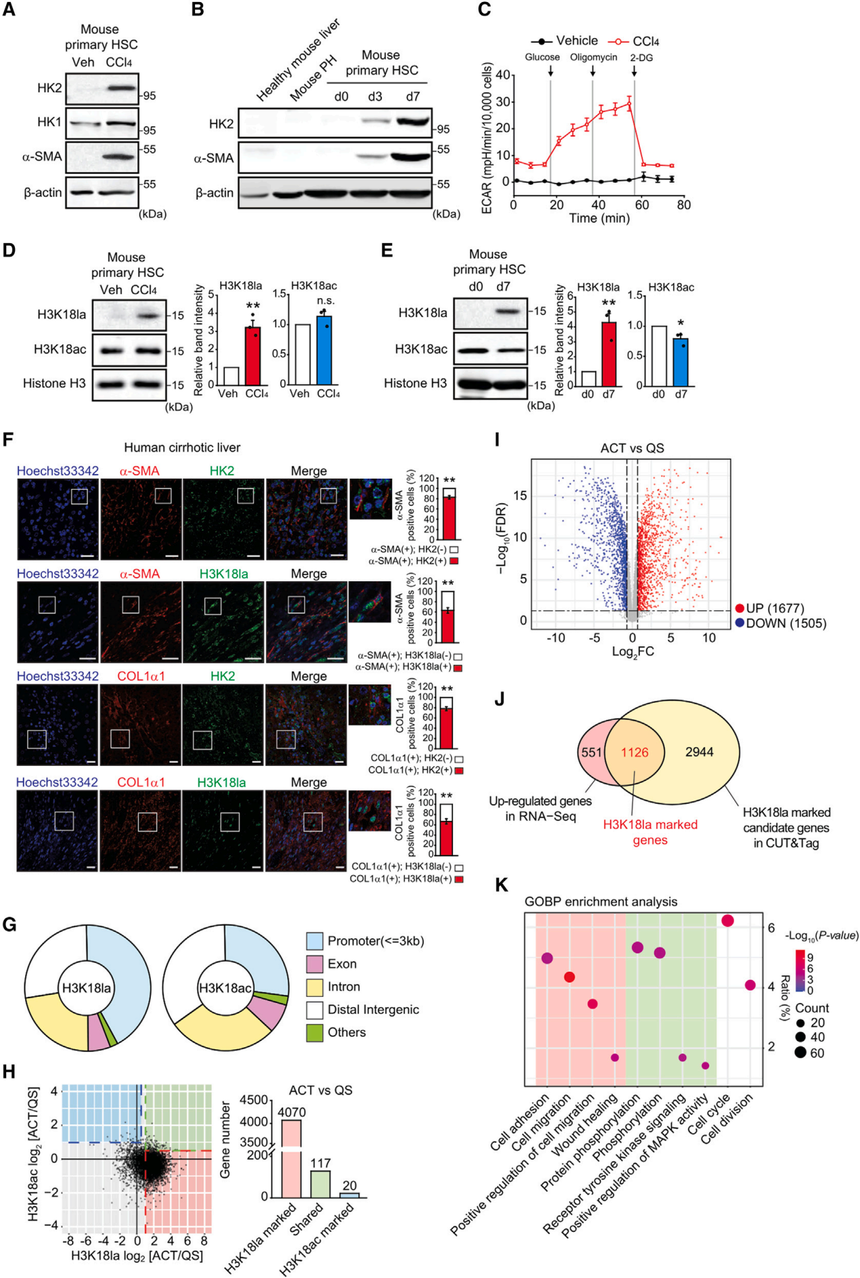
图2:HK2/H3K18la-特异性基因参与调控MI5-4 CHO细胞的基因表达和各种代谢过程 3. H3K18la在活化的小鼠和人造血干细胞中被诱导最近的研究表明,在慢性炎症和纤维化期间,增强的糖酵解作用不仅局限于癌细胞,而且还发生在肝、肺和肾的成纤维细胞中。虽然大量研究表明,星状细胞激活伴随着通过诱导各种糖酵解酶产生乳酸,但乳酸如何与星状细胞激活相关仍不清楚。基于作者在MI5-4 CHO细胞中的发现,推测HK2产生的乳酸可能通过组蛋白乳酸化影响基因表达。免疫印迹分析显示,HK2在注射CCl4的小鼠肝脏的原代造血干细胞中被稳定诱导表达,而HK1已经在健康肝脏的静止造血干细胞中表达,而在活化的造血干细胞中仅被轻微诱导。同样,在静止的造血干细胞中检测不到HK2的表达,但在培养3和7天的小鼠原代造血干细胞中,观察到HK2的强烈诱导表达并伴随着a-SMA的表达。 RNA-seq公共数据显示mRNA水平也验证了HK2的大幅诱导。接下来,对ECAR、乳酸产量和细胞乳酸水平的测量显示,活化的造血干细胞中糖酵解活性显著升高,导致在体内和体外激活过程中H3K18la的诱导。为了确定临床表现,作者对肝硬化患者的人类肝组织进行了双免疫荧光染色。患者肝脏免疫染色显示,82.9%±3.1%的a-SMA+细胞表达HK2,63.0% ±5.2%的a-SMA+细胞表达H3K18la,78.2%±3.6%的COL1a1+细胞表达HK2,H3K18la表达在66.6%±5.1%的细胞中(图3F),这些结果支持星状细胞激活与HK2表达和H3K18la存在的联系。总之,这些结果表明,诱导的HK2表达和糖酵解活性可能通过H3K18la在小鼠和人激活的造血干细胞中发挥作用。
图3:HK2/H3K18la在肝星状细胞激活过程中被诱导并调节基因表达 4. H3K18la在活化的造血干细胞中诱导的基因的启动子区域富集为了进一步确定H3K18la是否在星状细胞激活过程中的基因表达中发挥作用,作者对从健康肝脏新鲜分离或培养6天的小鼠原代造血干细胞进行了全基因组CUT&Tag检测。活化的造血干细胞中的H3K18la主要分布在启动子区域内(42.5%),而H3K18ac在启动子区域的分布程度则较低(27.4%),甚至低于内含子(28.2%)和远端基因间区域(34.5%)(图3G)。这些发现表明,H3K18la而不是H3K18ac,在HSC激活过程中诱导基因表达中起主要作用。 通过对启动子区域的分析,作者鉴定出4070个基因为H3K18la标记的候选基因,117个共享H3K18la和H3K18ac的基因,只有20个基因是H3K18ac标记的候选基因(图3H)。因此,活化的造血干细胞中绝大多数基因在启动子区域被H3K18la标记。 为了鉴定活化的造血干细胞中H3K18la标记的基因,作者在培养6天的原代造血干细胞中进行了RNA-seq测序,发现有1677个基因显著上调,有1505个基因在激活过程中显著下调(图3I)。最后,鉴定到1126个基因在启动子区H3K18la的诱导后表达上调。GOBP项分析显示,这些H3K18la标记的基因参与了细胞粘附、迁移和伤口愈合(图3K),提示H3K18la可能调控代表星状细胞主要特征的关键基因。 5. Hk2基因缺失通过减少H3K18la来抑制星状细胞的活化,这可以通过外源乳酸来挽救鉴于研究发现,活化的造血干细胞通过诱导糖酵解、HK2表达和H3K18la进行代谢重编程,作者推测HK2消融通过抑制H3K18la来抑制星状细胞的激活。为了验证假设,作者从Hk2f/f小鼠的肝脏中分离出原代造血干细胞,通过暴露于表达Cre重组酶融合到eGFP的腺病毒(Ad-GFP-Cre),进行基因缺失,然后培养6天。造血干细胞中Hk2的缺失使ECAR、乳酸产量和细胞乳酸水平降低了约60%(图4A-4C)。这种由Hk2缺失引起的代谢扰动抑制了a-SMA的表达和增殖,但没有导致细胞死亡(图4D)。与预期的一样,WT原代造血干细胞的激活不受腺病毒Cre转导的影响。 确定了Hk2消融对糖酵解活性和星状细胞活化的影响,作者接下来检测了H3K18la和H3K18ac的水平。Hk2缺失的细胞中H3K18la和H3K18ac水平低于活化的造血干细胞,但外源性乳酸处理恢复了H3K18la,而H3K18ac水平进一步降低(图4E)。同样,CUT&Tag结果的热图分析显示,在活化的小鼠原代造血干细胞中,基因的TSS附近的H3K18la显著诱导,由于Hk2缺失而减少,并在添加乳酸后恢复(图4F)。相比之下,H3K18ac在活化的造血干细胞中减少,并在Hk2缺失和乳酸处理后进一步降低。 为了进一步研究H3K18la标记基因是否依赖于HK2的表达和乳酸处理,作者比较了活化的H3K18la标记基因在活化的WT造血干细胞和活化的HK2敲除(KO)造血干细胞中的表达。在激活的HK2-KO细胞中,下调的基因增加了大约3倍(图4G)。乳酸处理逆转了大多数依赖于HK2表达的基因的表达(图4H)。在活化的造血干细胞中,H3K18la峰在关键诱导基因的启动子上高度富集,但在静止细胞和HK2-KO细胞中不富集,但在HK2-KO细胞中,乳酸处理恢复了H3K18la峰(图4I和4J)。 已知补充醋酸盐可以增加组蛋白乙酰化和染色质可及性。为了评估乳酸和醋酸处理是否能恢复HK2-KO造血干细胞的基因表达,研究测量了星状细胞激活诱导基因的转录水平。令人惊讶的是,乳酸处理上调了被Hk2缺失抑制的基因表达,而醋酸处理没有(图4K)。同样,活化的造血干细胞的侵袭能力降低,但乳酸处理挽救,而醋酸处理没有恢复表型(图4L)。总的来说,研究结果表明,Hk2缺失抑制了星状细胞的活化,这可以通过乳酸处理(可能通过H3K18la)来挽救,而不是通过醋酸处理。
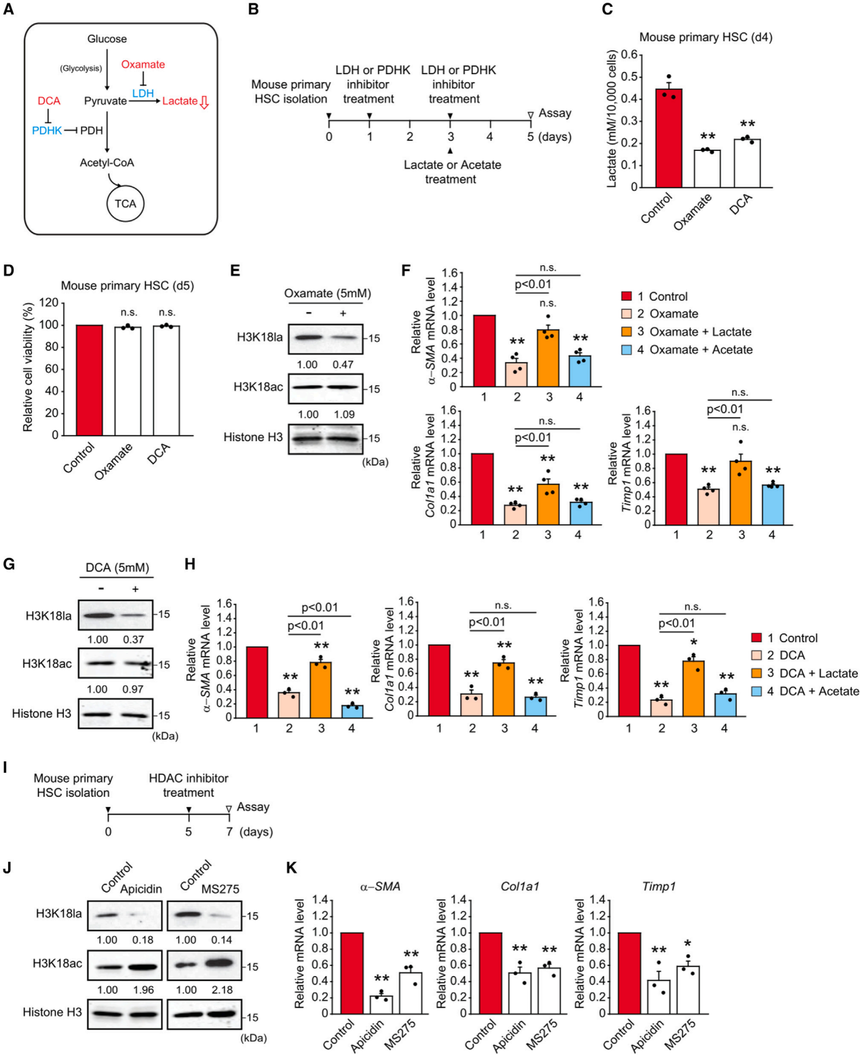
图4. Hk2基因缺失通过减少H3K18la来抑制星状细胞的活化,这可以通过外源乳酸而不是醋酸处理来挽救 6. 乳酸产生的药理抑制抑制星状细胞的活化,被外源乳酸而不是醋酸挽救为了继续研究组蛋白乳酸化和星状细胞活化之间的关系,作者进一步评估了使用乳酸产物的药理抑制剂治疗后基因表达的激活。草氨酸盐和二氯乙酸酯(DCA)由于其具有调节糖酵解的能力,已被评价为抗癌药物。草酸酯通过抑制乳酸脱氢酶(LDH)来抑制丙酮酸产生乳酸,而DCA通过增加丙酮酸向乙酰辅酶a的转化来抑制乳酸的产生,而不是通过抑制丙酮酸脱氢酶激酶(PDHK)来抑制乳酸的生成(图5A)。如此前报道,草氨酸盐和二氯乙酸酯显著减少了乳酸的产品以及细胞乳酸水平,这种干预抑制了小鼠原代造血干细胞的细胞增殖而不导致细胞死亡(图5D)。草酸和DCA处理有效降低了H3K18la,并降低了星状细胞激活诱导基因的表达,这些基因被乳酸挽救,而醋酸没有(图5E-H)。
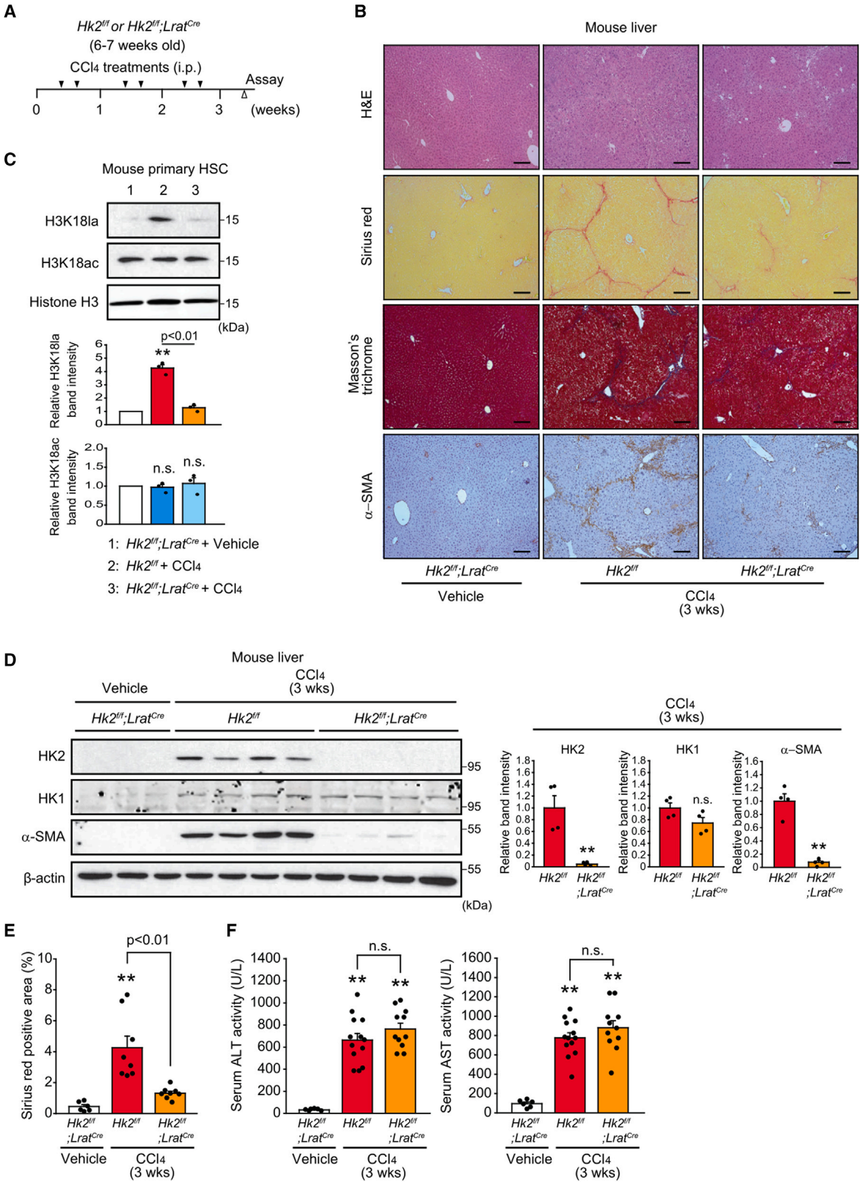
图5. 通过抑制乳酸产生或I类HDAC抑制剂处理降低H3K18la可使造血干细胞失活 7. I类HDAC抑制剂可提高H3K18ac,但抑制H3K18la,从而抑制星状细胞活化诱导基因的表达研究用I类HDAC抑制剂阿皮素和MS275(恩替司他)处理活化的小鼠原发性造血干细胞(图5I)。抑制剂处理增加了H3K18ac,但降低了H3K18la,表明赖氨酸18上的乙酰化和乳酸化之间存在竞争(图5J)。研究结果表明,I类HDAC抑制剂可能通过上调H3K18ac来失活造血干细胞,H3K18ac与H3K18la竞争,导致H3K18la依赖的基因表达下调。 8. HSC特异性和系统性Hk2缺失抑制体内肝纤维化为了进一步证实HK2/H3K18la在造血干细胞中在肝纤维化中的作用,作者首先生成了Hk2f/f;LratCre小鼠,其中Hk2可以在造血干细胞中特异性缺失。小鼠注射四氯化碳3周,诱导肝纤维化(图6A)。天狼星红和马苏三色染色结果表明,当造血干细胞中Hk2缺失时,四氯化碳引起的肝脏中胶原积累明显减少(图6B和6E)。同时进行的胶原沉积结果显示,在hsc特异性的HK2-KO小鼠肝脏中,a-SMA的表达显著降低(图6B和6D)。 为了验证H3K18la水平是否反映了体内造血干细胞的激活,作者在四氯化碳给药后从Hk2f/f或HSC特异性HK2-KO小鼠的肝脏中分离出小鼠原代造血干细胞。四氯化碳给药后,由于Hk2缺失小鼠原代造血干细胞诱导的H3K18la水平显著降低。然而,H3K18ac水平没有变化。接下来,对ALT(丙氨酸转氨酶)和AST(天冬氨酸转氨酶)的测定显示,造血干细胞中Hk2的缺失对肝毒性没有显著影响(图6F)。这部分结果表明HSC特异性Hk2缺失可减轻造血干细胞中的H3K18la,并抑制肝纤维化,而体内慢性和全身乳酸治疗可恢复胶原沉积和a-SMA表达。 以往研究报道显示成年小鼠的系统性Hk2缺失耐受性良好,可以治疗乳腺癌和肺癌,而且没有不良的生理后果。为了确定HK2是肝纤维化的治疗靶点,使用Hk2f/f;UBCCreERT2小鼠来模拟药物治疗,该小鼠含有广泛表达的他莫昔芬诱导的Cre重组酶。在单剂量CCl4激发实验中,作者观察到3区(小叶中心)的肝细胞在富含Hk2和系统缺乏Hk2的小鼠中都受到了类似的损伤。然而,a-SMA在Hk2系统性缺失小鼠肝脏中的表达明显被抑制。接下来,作者用四氯化碳治疗刺激全身Hk2缺失的小鼠3周(图7A)。天狼星红和马苏三色染色结果显示,在Hk2系统缺失后,肝脏中的胶原蛋白积累明显受到抑制(图7B和7D)。 为了进一步分析系统性Hk2缺失的抗纤维化作用,接下来在注射他莫昔芬后的Hk2f/f;UBCCreERT2小鼠中建立了BDL诱导的纤维化模型(图7F)。与之前的体内实验中发现一致,系统性Hk2缺失有效抑制bdl小鼠肝脏中胶原积累和a-SMA的表达(图7G-7I)。在CCL4诱导和BDL诱导的纤维化模型中,Hk2熟练组和Hk2缺陷组的血清ALT和AST活性相似,这表明体内全身Hk2缺失不会引起显著的细胞毒性(图7E和7J)。
图7 通过体内全身缺失Hk2抑制ccl4诱导和bdl诱导的肝纤维化 延伸拓展: 该研究以己糖激酶HK2为切入点,联合组蛋白乳酸化H3K18la解析HK2在肝纤维化中的作用机制,HK2可能是肝纤维化的有效靶点。不过,该研究也提到了一些研究局限性。研究揭示了星状细胞激活过程中星状细胞激活诱导基因的启动子被H3K18la标记,但作者也发现激活过程中糖酵解增强通过乳酸化影响H3和H4上的不同赖氨酸残基,以及非组蛋白。组蛋白H3和H4其他位点乳酸化以及非组蛋白的乳酸化研究也可以进一步分析,从而完善肝纤维化机制。 糖酵解和乳酸化都是医学研究热点,本文将糖酵解途径己糖激酶与组蛋白乳酸化H3K18la联合起来,可以作为一种参考思路拓展到其他疾病机制。此外,糖酵解途径中的其他关键酶是否也可以作为切入点,值得考虑。 爱基百客专注于提供领先的表观组学服务,可提供方案设计、样本制备、测序、分析以及验证一站式服务。有相关需求的老师欢迎联系区域销售。 DOI: https://doi.org/10.1016/j.cmet.2023.06.013 武汉爱基百客生物科技有限公司(简称爱基百客),位于武汉高农生物园,是一家专业提供表观组学科研服务、单细胞与空间组学测序分析和高通量测序分析的新型生物科技服务企业。公司先后引入ChIP、CUT&Tag、WGBS、ATAC-seq、全转录组、10x Genomics、DNBSEQ-T7等实验平台,不断提升公司的科研服务能力。 运营至今合作的科研客户超2000家,涵盖国内知名科研院所、高校以及相关生物企业,科研成果曾多次在Cancer Cell、Nature Communications、J HEMATOL ONCOL、Plant Cell 等国际高水平学术期刊发表,受到了客户广泛好评,是国内成长最迅速的高通量测序科研服务企业之一。
市场部小助理,项目咨询 了 解 更 多 { 往 期 精 彩 回 顾 } |