NEWS
新闻资讯
|
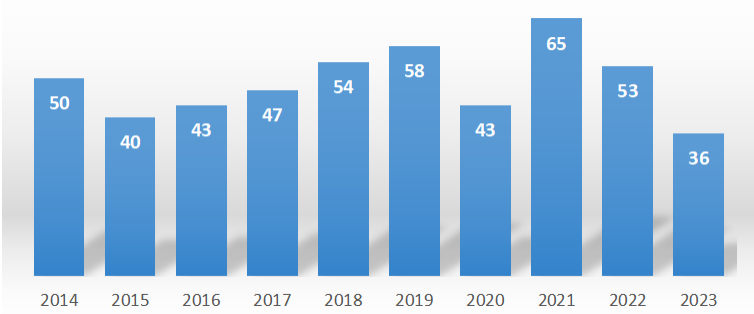
组蛋白修饰 | 一文带你了解H3K4me3近年来,关于H3K4me3的研究越来越多,相关的文章数也大体呈上升趋势。根据NCBI数据检索,近10年(2014-2023),H3K4me3相关的文章数高达3161篇,H3K4me3发表在影响因子大于10的期刊发文数为489篇。从发表文章数量上看,H3K4me3是值得关注的研究热点。
图1. H3K4me3相关文章发表走势图(2014-2023.08;数据源于:NCBI)
图2. H3K4me3历年相关文章发表走势图(2014-2023.08;IF>10;数据源于:NCBI) 01 导 读 组蛋白修饰是指在组蛋白的氨基酸残基上所进行的诸如甲基化、乙酰化、泛素化以及巴豆酰化等一系列修饰,从而影响下游蛋白的表达及功能的发挥,进而决定细胞的状态,影响胚胎的发生和发育,是表观遗传信息的重要载体和生命活动的重要调控因子。 组蛋白甲基化修饰是由组蛋白甲基化转移酶(Histone melthyltransferases,HMT)催化,常发生在H3、H4 组蛋白N端赖氨酸或精氨酸残基,包括单甲基化、双甲基化和三甲基化,参与转录调控、基因组完整性维持及表观遗传模式的传递,是表观遗传学重要机制之一。 H3K4me3是组蛋白H3第四位赖氨酸在甲基转移酶 (HMT) 催化下发生三甲基化。H3K4me3是最重要的甲基化修饰之一,真核生物中该修饰在转录起始位点普遍发生,通常在基因的启动子附近富集,并且与基因的转录相关,是表观遗传学一个标志,其水平可以反映出转录的程度,在基因的转录中有着重要的作用。 02 H3K4me3书写器、擦除器和阅读器 组蛋白的PTM是表观遗传机制的关键组成部分,它提供基于蛋白质的调控信息,而不是嵌入DNA序列中的调控线索。在调控表观遗传机制的参与者中,有书写器writers、阅读器readers和擦除器erasers[1]。writers是修饰添加酶,将修饰添加到组蛋白、非组蛋白、DNA和RNA中,readers读取writers所写线索的蛋白质,而erasers则是清除PTM所含化学信息的酶。 虽然H3K4me3相对稳定,有可能持续数小时和数天,但它也是一个动态指标,其水平反映了赖氨酸甲基转移酶(KMTs)沉积和赖氨酸去甲基酶(KDM)清除之间的平衡。
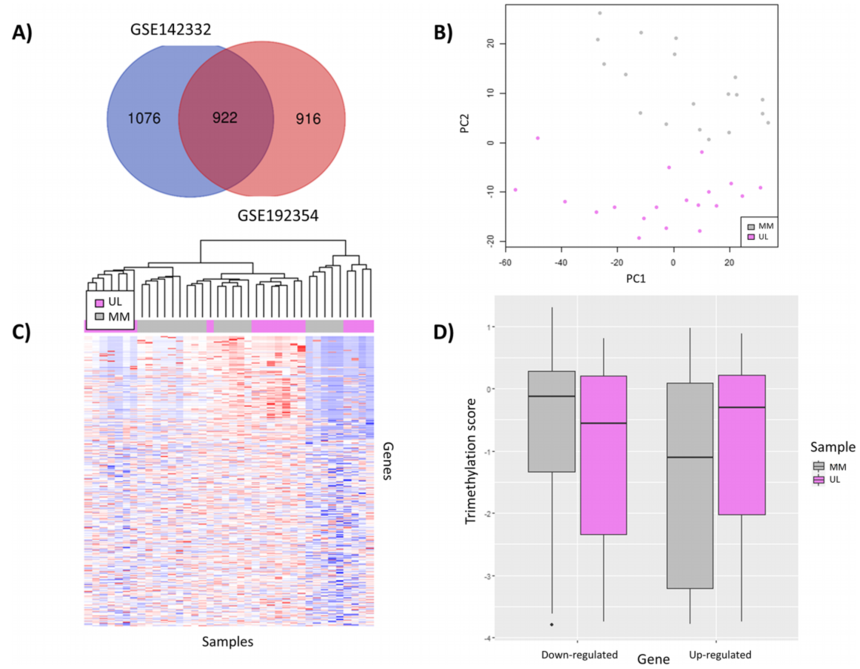
图3. H3K4me3的writers、erasers和潜在readers(图片源于:Beacon et al. Clin Epigenet (2021) 13:138) 03 H3K4me3的功能 · H3K4me3在转录中的已知功能 先前的一项研究表明,含有启动子近端H3K4me3的基因中有80%在人类干细胞中活跃转录[2]。此外,H3K4me3通过与转录起始和延伸的基本因子相互作用来促进转录;除了RNA聚合酶II介导的转录外,H3K4me3也与许多核功能有关,例如,生长抑制因子1(ING1)的活性需要PHD指域与H3K4me3相互作用才能进行DNA损伤修复[3];H3K4me3在DNA重组和前mRNA剪接中也发挥作用[3-5]。因此,H3K4me3可能是一个保守的多功能表观遗传标记,可以支持多种DNA或RNA相关的细胞过程。 然而,作为近年来研究热点的H3K4me3是否参与了其他生命活动过程呢?让我们接着一起往下看。 1. H3K4me3与子宫肌瘤 子宫肌瘤(UL)是育龄妇女最常见的良性肿瘤。它们的病理机制尚不清楚,这阻碍了安全有效的治疗方法的开发。越来越多的证据表明,表观遗传学是参与肿瘤发展的主要机制。组蛋白修饰是基因表达表观遗传调控的关键组成部分。具体地说,促进基因表达的组蛋白标记H3K4me3在许多肿瘤中都会发生变化。Carbajo-García等[6]研究发现子宫肌瘤与其邻近子宫肌组织相比,H3K4me3整体受到抑制,并且子宫肌瘤相关差异表达基因的转录是由H3K4me3表观遗传介导的。总之,H3K4me3不稳定性改变癌基因和抑癌基因的表达,导致增殖失常,Wnt/β-catenin和TGF-β通路失调,最终诱发子宫肌瘤。
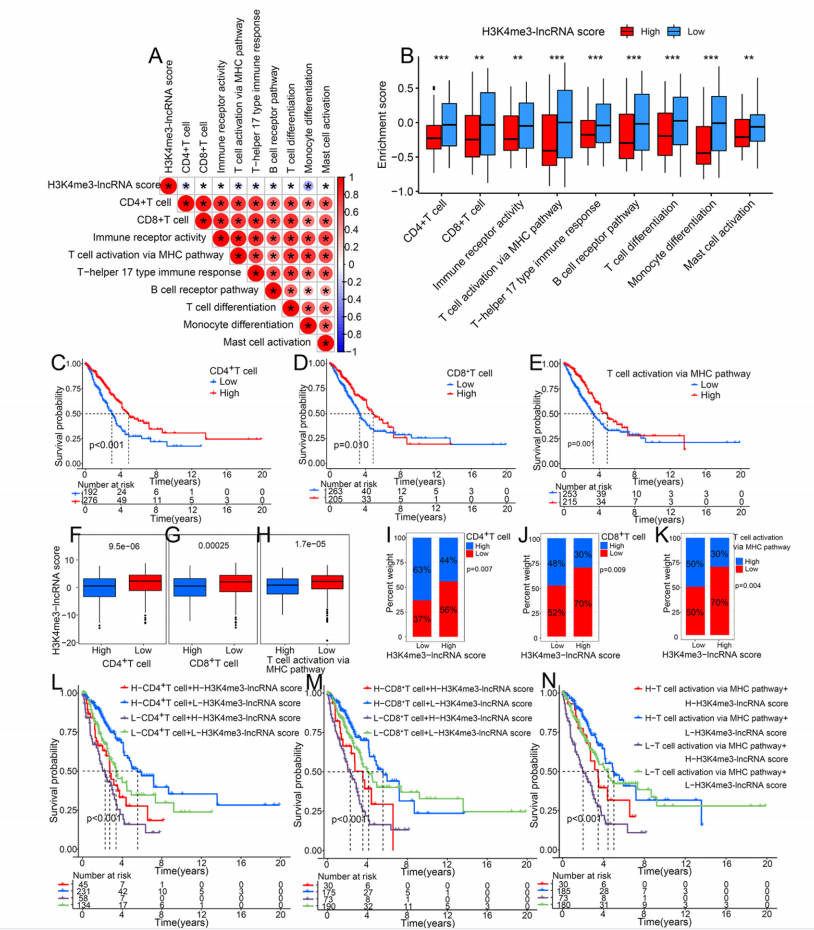
图4. 子宫肌瘤与子宫肌层组织中差异表达基因的筛选及其H3K4me3状态的描述 2. H3K4me3与肺腺癌 表观遗传修饰在肿瘤发生中的作用已被广泛报道。然而,H3K4me3修饰在肺腺癌(LUAD)中的作用和机制却鲜有系统报道。Fan等[7]首次基于H3K4me3及其密切相关的lncRNA的表达构建了三个不同的H3K4me3-lncRNA群。此外,他们还展示了每个群组特定的肿瘤微环境(TME)免疫特征。H3K4me3-lncRNA评分与免疫特征之间的高度一致性揭示了H3K4me3在重塑肿瘤免疫微环境中的重要作用。为此,他们评估了每个样本的H3K4me3水平,并进一步分析了H3K4me3调控肿瘤进展的潜在分子机制。通过大样本量证实了H3K4me3修饰在LUAD中的抗癌作用和免疫机制,有助于我们深入了解TME的免疫调节作用,为研究H3K4me3修饰在肿瘤发生和肿瘤免疫原性中的作用提供了新的思路。
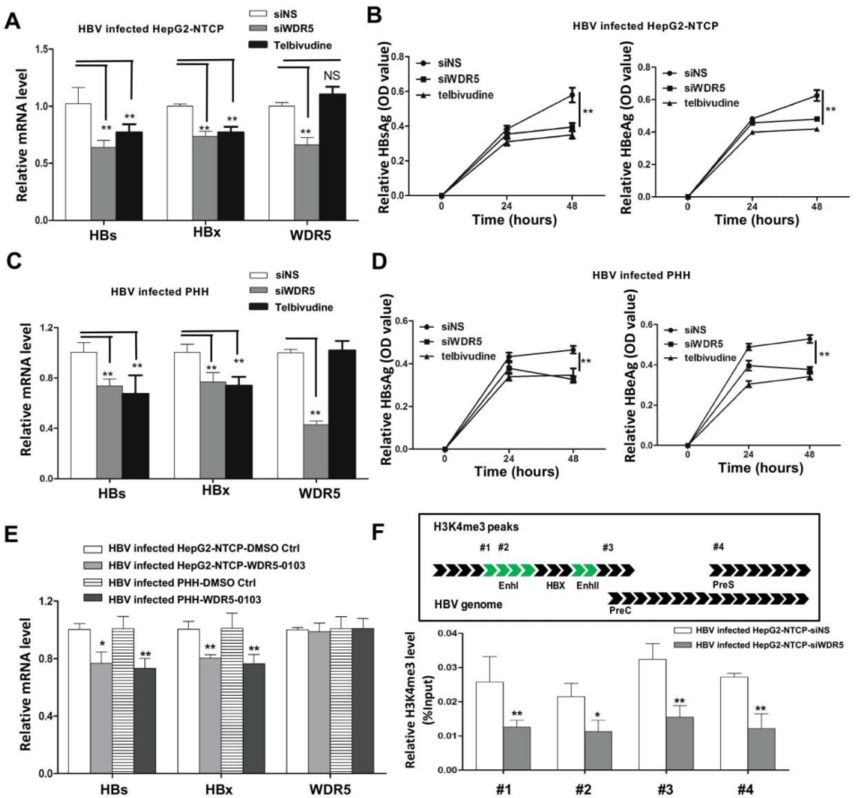
图5. H3K4me3-lncRNA评分与免疫细胞激活相关通路的关系 3. H3K4me3与肝癌 虽然大量研究表明,表观遗传酶的结构、功能或表达水平的异常与许多肿瘤类型有关,但表观遗传机制如何参与乙肝病毒(HBV)诱导的肝细胞癌(HCC)的确切机制仍不清楚。Gao等[8]发现WD重复结构域5蛋白(WDR5)-组蛋白H3赖氨酸4甲基转移酶复合体的核心亚基,催化H3K4me3的产生——在乙肝相关性肝癌中高表达,并促进肝癌的发展。WDR5在乙肝病毒诱导的小鼠细胞增殖和肿瘤生长中起关键作用,WDR5-0103活性的小分子抑制剂WDR5-0103可抑制乙肝病毒和乙肝病毒x蛋白(HBx)驱动的肿瘤增殖。异常高的WDR5蛋白水平被发现与HBX有关,它通过抑制损伤特异性DNA结合蛋白1/cullin-4与WDR5之间的相互作用来稳定WDR5蛋白,导致WDR5蛋白泛素化降低。HBx与WDR5共定位于染色质全基因组,并通过WDR5促进全基因组的H3K4me3修饰。 此外,HBx在靶基因启动子中的招募依赖于它通过α-螺旋结构域与WDR5的相互作用。WDR5还通过H3K4修饰共价闭合环状DNA微染色体来促进乙肝病毒的转录,而WDR5-0103则能抑制乙肝病毒的转录。最后,体内外实验数据进一步证明HBx以WDR5依赖的方式发挥其促肿瘤作用。这些数据表明,WDR5是乙肝病毒诱导的肿瘤发生的关键表观遗传学决定因素,HBx-WDR5-H3K4me3轴可能是乙肝病毒诱导的肝脏发病的潜在治疗靶点。
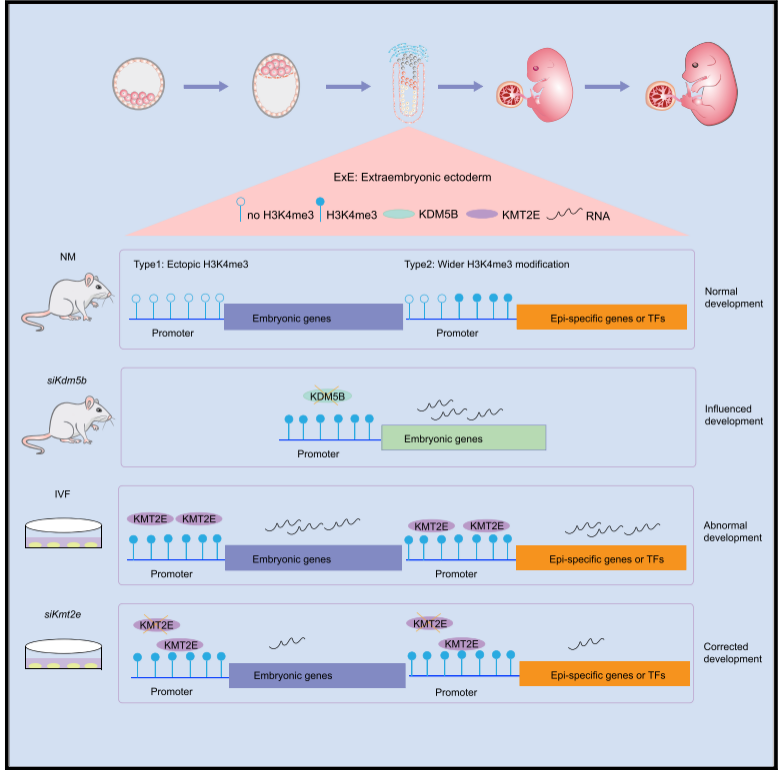
图6. WDR5通过cccDNA微染色质的H3K4me3促进HBV转录 4. H3K4me3与体外受精 辅助生殖技术已广泛应用于人类不孕不育的治疗。然而,越来越多的证据表明,体外受精(IVF)与低妊娠率、胎盘缺陷和后代代谢性疾病有关。Bai等[9]研究发现体外受精操作显著干扰了胚外组织特异性基因的表达,并且在胚胎7.5天的体外受精胚胎的胚外外胚层(ExE)中,334个外胚层(Epi)特异性基因和24个Epi特异性转录因子异常表达。联合组蛋白修饰分析表明,在Epi活性启动子上的H3K4me3异常修饰导致这些基因在ExE中的表达增加。重要的是,作者证明了在试管受精胚胎中高表达的H3K4me3招募调节因子Kmt2e的敲除大大促进了试管受精胚胎的发育,并减少了ExE中的异常基因表达。因此,他们的研究发现胚胎外组织中H3K4me3的异常修饰是导致体外受精胚胎着床失败和胎盘发育异常的主要原因。
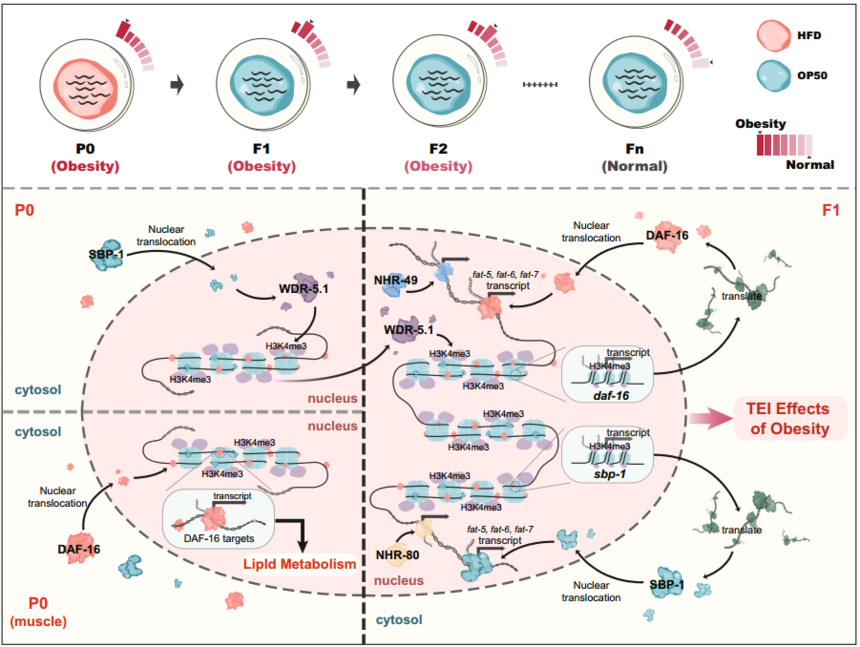
图7. H3K4me3调控体外受精胚胎着床失败和胎盘发育异常模型图 5. H3K4me3与脂代谢 肥胖作为人类健康的主要风险因素,给人们和社会带来了巨大的负担。有趣的是,父母的肥胖状态可以通过表观遗传在多个物种中导致后代的脂肪积累。到目前为止,关于脂类积累如何导致信号在几代人之间传递的问题仍然存在。Wan等[10]建立了一个线虫模型,用高脂肪饮食(HFD)饲养的线虫可导致可测量的脂质积累,并可将脂质积累信号传递给其多代后代。 利用这个模型,他们发现转录因子DAF-16/FOXO和SBP-1/SREBP,核受体NHR-49和NHR-80,以及delta-9去饱和酶(fat-5,fat-6和fat-7)是跨代脂肪积累所必需的。此外,H3K4me3标记了脂代谢基因,并增加了它们对多代肥胖效应的转录反应。总而言之,这项研究建立了脂代谢基因网络和染色质修饰之间的相互作用,它们共同实现了肥胖效应的跨代表观遗传。
图8. HFD诱导脂质积累的跨代遗传模型综述 04 H3K4me3最新案例 2023年3月1日美国纪念斯隆-凯瑟琳癌症中心细胞生物学项目的Kristian Helin研究团队在Nature上发表了题为“H3K4me3 regulates RNA polymerase II promoter-proximal pause-release”的文章,揭示了H3K4me3在转录过程中的作用机制。
组蛋白H3赖氨酸4的三甲基化(H3K4me3)被认为参与调节转录起始。然而,H3K4SET1/COMPASS甲基转移酶复合体的复杂功能使研H3K4me3在转录调控中的某一特定作用变得困难。本文中,以小鼠胚胎干细胞为模型,作者证明了快速降解SET1/COMPASS复合物亚基会导致H3K4甲基化的完全丧失。H3K4me3的周转依赖于KDM5去甲基酶,其变化速度快于H3K4me1和H3K4me2。值得注意的是,H3K4me3的严重丢失对转录起始没有明显影响,但导致了转录产出的普遍下调,RNA聚合酶II(RNAPII)含量暂停增加,延伸变慢。作者发现H3K4me3对募集和清除停滞的RNAPII是必要的。 在该研究中,研究人员发现H3K4me3在细胞体内是通过转录暂停-释放过程来调节基因表达,而不是以往认为的促进基因转录起始,并阐明了H3K4me3调控这一过程的全新机制。 05 小 结 随着全基因组测序技术的发展,对动植物全基因组的蛋白及DNA的甲基化有了更深一层的了解,但对各种甲基化在细胞发育过程中的调控机制仍然不是十分清楚。H3K4me3作为一种广为人知的组蛋白修饰,不仅参与转录起始、延伸和RNA剪接,而且该修饰也与多种疾病以及其他一些生命活动相关。进一步的研究将有助于揭示H3K4me3在基因调控网络中的作用机制,并为相关疾病的诊断和治疗提供新的靶点和策略。 爱基百客专注于提供领先的表观组学服务,可提供方案设计、样本制备、测序、分析以及验证一站式服务。在组蛋白修饰上我们具有丰富的项目经验,有相关需求的老师欢迎联系区域销售。目前,我们有新产品单细胞ChIP-seq,可以在单细胞水平上表征细胞的组蛋白修饰,欢迎有需要的老师咨询。
市场部小助理,项目咨询
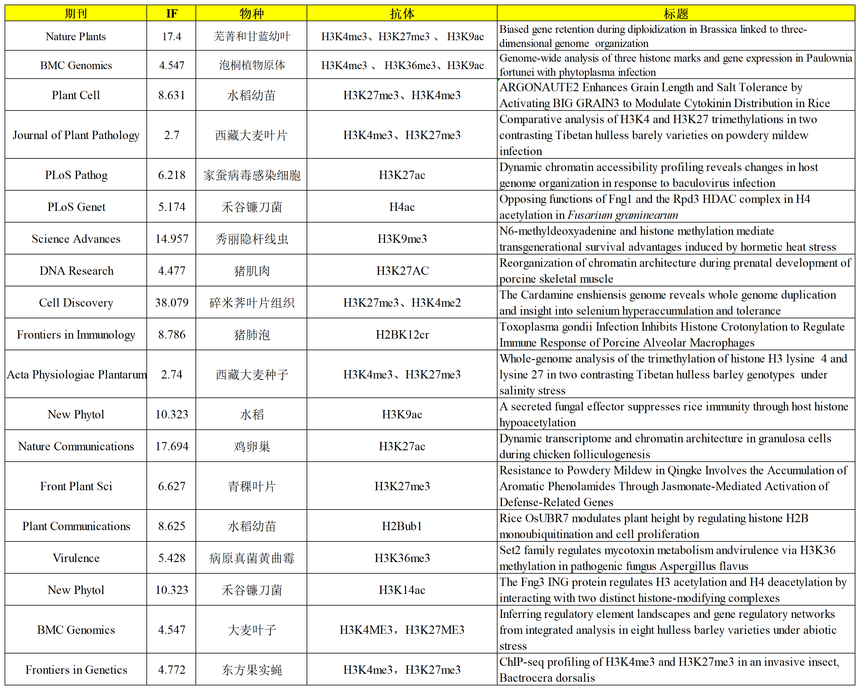
图9. 爱基百客部分组蛋白修饰项目文章 参考文献:
了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |