NEWS
新闻资讯
|
Nature commun |晚期胰腺导管腺癌中自发进化的祖细胞niches逃避Yap癌基因成瘾“致癌基因成瘾”用于描述癌细胞通常表现出对一种或多种致癌驱动因素的严格依赖性以维持肿瘤生长和进展的现象。几乎所有肿瘤在药物缓解后都会出现最终的肿瘤复发。那么,在晚期胰腺导管腺癌(PDAC)中结合RNA-seq和Cut&Tag技术对肿瘤自发复发研究有什么样的影响呢?看看今天我们带来的文章。
发表单位:美国华盛顿乔治敦大学医学中心 期 刊 : Nature communications(IF:16.6) 发表日期:2023年3月15日 研究技术:Cut&Tag、RNA-seq(爱基百客均可提供) 2023年美国华盛顿乔治敦大学医学中心的Chan D. K. Nguyen1 & Chunling Yi研究团队在期刊Nature communications(IF:16.6)发表了题为“Spontaneously evolved progenitor niches scape Yap oncogene addiction in advanced ancreatic ductal adenocarcinomas”的研究论文。该研究阐明了谱系可塑性使晚期PDAC肿瘤在消除中心致癌驱动基因Yap后发生自发复发。 01 研究背景 几乎所有的肿瘤缓解之后,都会出现最终的肿瘤复发,因此研究癌细胞适应癌基因抑制的机制对于实现患者持续的肿瘤控制是至关重要的。作者在该研究阐明了谱系可塑性使晚期胰管腺癌肿瘤在消除中心致癌因子Yap后自发复发结果,并发现Yap和BET抑制剂联合具有治疗PDAC的潜力。 02 研究思路
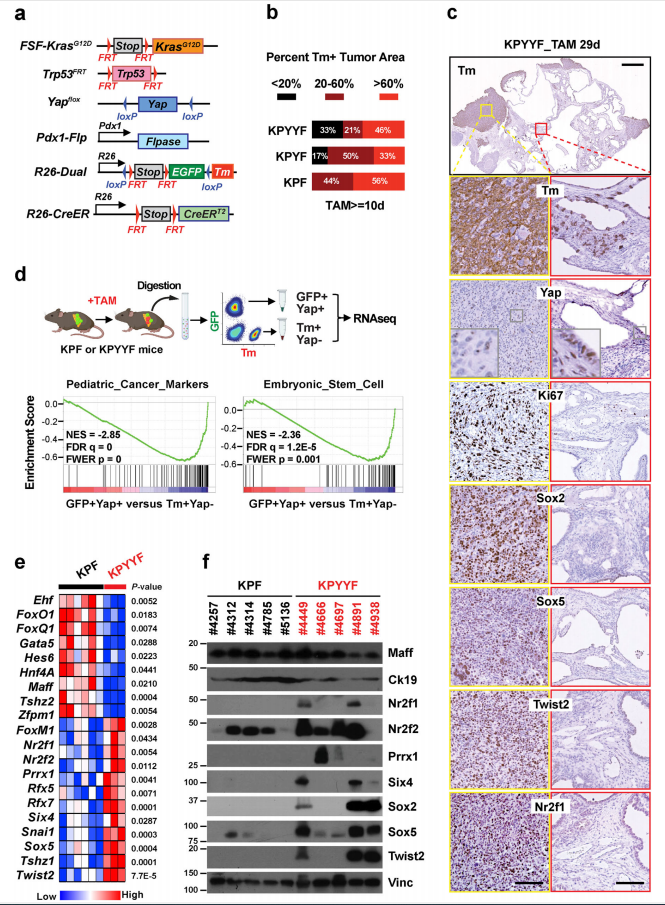
03 研究结果 1. Yap消融后,部分晚期Kras:p53突变型PDAC肿瘤发展为具有胚胎祖细胞特征的自发复发病变 作者首先进行突变小鼠模型构建,其中KPF作为对照(图1.a)。由于已有实验表明Yap消融阻止早期胰腺病变的开始和进展。因此初生小鼠的PDAC肿瘤在Yap存在下发展可触及后,再进行他莫昔芬(TAM:抗肿瘤药物)喂食。免疫组化法(IHC)分析显示:10天的TAM治疗诱导KFP中广泛的tdTomato (Tm)表达;KPYYF中,近1/3的肿瘤Tm+细胞含量<20%,几乎一半表现出广泛Tm激活,表明Yap虽然表达水平降低,但在整个肿瘤中仍然表达(图1.b)。此外,三分之一的KPYYF小鼠在延长TAM治疗后出现了局部、高增殖的Tm+Yap−复发结节,这些结节不依赖Yap,分化较差,且更倾向于PDAC肿瘤周围(图1.b和c)。 对经TAM治疗的KPYYF和KPF的结节进行GFP+Yap+和Tm+Yap− PDAC细胞分离和测序。结果表明:Tm+Yap− PDAC细胞中儿科肿瘤标记物、多能/祖细胞、胚胎干细胞、上皮向充质转化(EMT)和Myc靶基因的标记物明显上调;参与上皮分化和胞间连接组织的基因显著下调(图1.d)。差异转录因子分析表明:Tm+Yap− PDAC中,多能性和/或祖细胞特征相关基因(Sox2、Sox5、Twist2、Six4、Nr2f1、Nr2f2、Prrx1)高表达,上皮谱系TFs(Foxq1、Foxa2、Hnf4a、Ehf、Gata4)则显著下调(图1.e-f)。 此外,人PDAC细胞系Yap敲除使PTFs(多能转录因子)的一个亚群上调。人PDAC患者具有PTF高表达和KPYYF结节中基因高表达的存活率低于低水平复发相关患者。因此,小鼠PDAC肿瘤适应Yap失活的同一组基因也可能在人类PDAC患者中产生普遍的治疗抵抗。
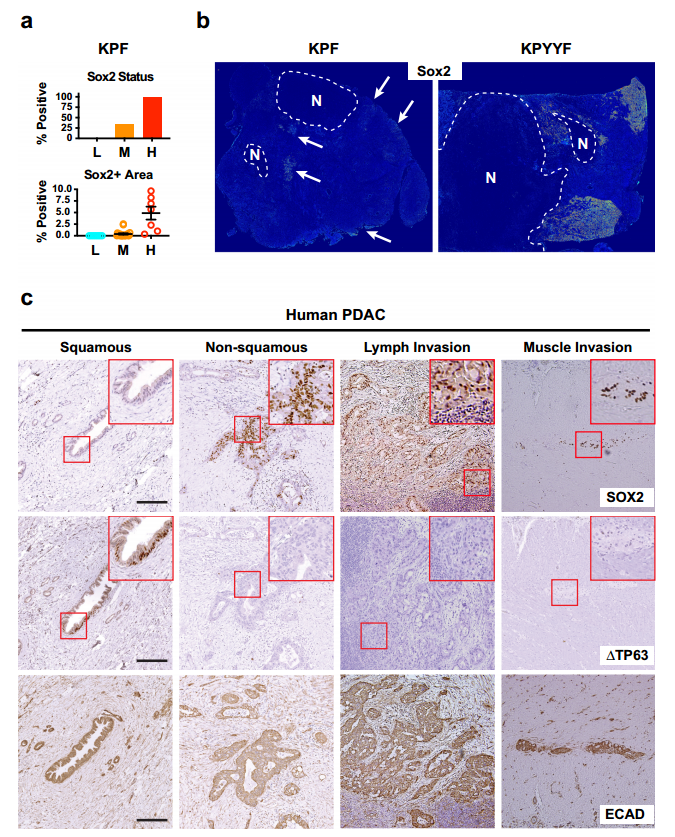
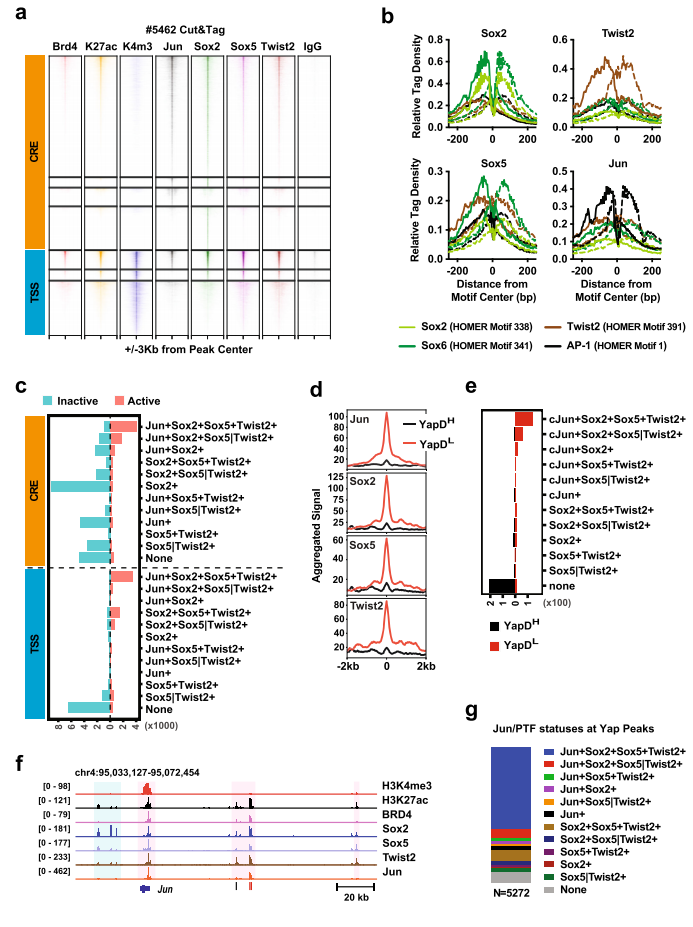
图1. Kras:p53突变的PDAC肿瘤的一个子集在Yap消融后发展为具有胚胎前体特征的自发复发病变。 2. 表达Yap的晚期小鼠和人PDAC肿瘤自发形成表达PTFs“祖细胞” niches TAM 治疗后,约1/3的 KPYYF 肿瘤发展为高度增殖的 Tm + Yap-复发结节,表明存在具有适应 Yap 丢失的 PDAC 细胞罕见亚群(图1.c)。Yap+KPF肿瘤IHC分析显示转录因子Sox2和PTFs表达于中等和高等级别肿瘤区域、一些坏死区域或侵袭前附近含有表达Sox2和其他PTF的恶性细胞簇(图2.a和b)。此外,TAM治疗后不依赖Yap的复发病出现位置与KPYYF肿瘤相似,且具有高水平的核Myc和Myc靶基因(图1.c、图2.b)。这表明先前存在的表达PTF的niches可能通过激活Myc来响应Yap敲除而扩大。 但是,人类PDAC肿瘤是否能够自发性获得PTF表达呢?作者通过对手术切除的3期肿瘤进行染色和检测发现,在PDAC肿瘤的不同位置检测到表达Sox2、Sox5和/或NR2F1的PDAC细胞小袋,且PTF+在人和小鼠的PDAC中具有相似Yap表达(图2.c)。这意味着在肿瘤进展过程中,人和小鼠PDAC细胞中都发生了PTF的自发激活。
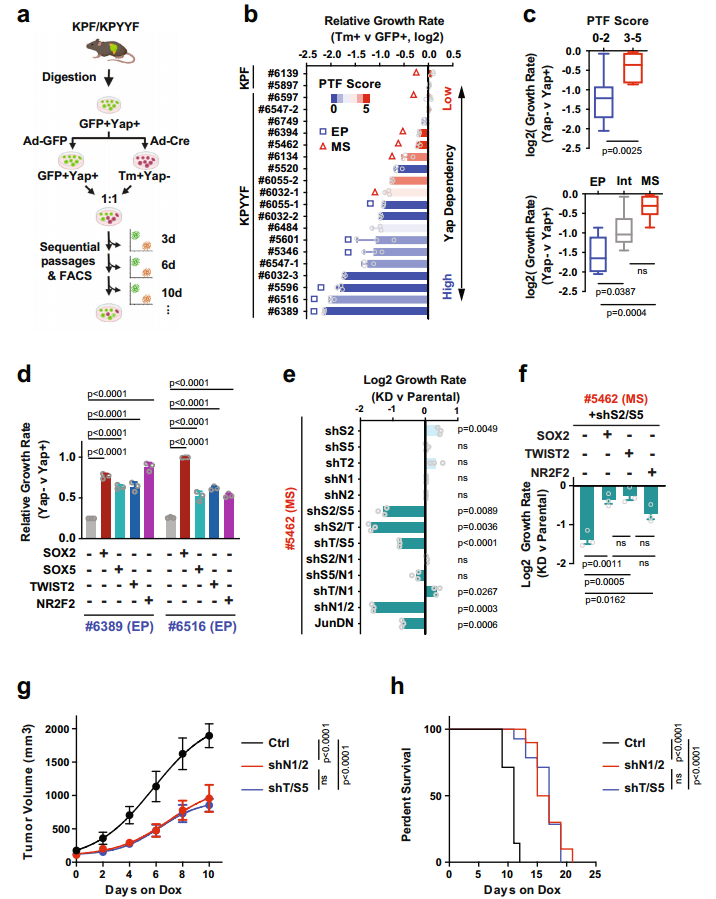
图2. 表达Yap的晚期小鼠和人PDAC肿瘤自发形成表达PTF的“祖细胞”niches。 3. PTF表达获得与EMT和Yap消融抵抗有关 Yap依赖和PTF表达之间有什么关系呢?作者建立了19个KPF和KPYYF原发PDAC肿瘤培养物(图3.a)。免疫荧光、免疫组化和WB表明原代PDAC培养物在很大程度上保留了原PDAC肿瘤的分化状态。原代细胞分为上皮型(EP)、中间型(Int)和间充质型(MS)。定量Yap依赖性试验评估PDAC细胞对YAP的依耐性(图3.a),发现KPF细胞衍生的GFP+和Tm+群体之间的增殖无差异,但不同的KPYYF细胞系中Tm+Yap−和GFP+Yap+细胞的比例随时间变化很大(图3.b)。这表明PTF分数低的EP系对Yap的依赖性更高(图3.b和c)。 PDAC肿瘤进化的自然过程中自发获得PTF表达,与Yap表达无关,其可能使PDAC肿瘤细胞的一个亚群克服对Yap的依赖。 4. 单个PTF的表达足以克服Yap依赖性 作者评估单个PTF影响PDAC细胞对Yap的依耐性。在两个具有低PTF评分和Yap高依耐性的PDAC细胞系(#6389和#6516)中进行单个PTF表达(图3.b)。依耐性检测实验表明(图3.a),在PTF重建细胞中,Tm + Yap-相对于亲本细胞GFP + Yap+ 细胞比率基本保持稳定,虽然随着时间推移略有下降,但单个PTF外源表达足以覆盖(至少部分地)PDAC细胞对Yap的依赖性(图3.d)。 5. PTF的表达是维持Yap非依赖性PDAC细胞生长所必需的 为了评估PTF对高PTE评分和低Yap依赖性的PDAC细胞增值的作用,研究选择#5462 PDAC原代细胞系,其具有Yap独立相关的5种PTF高表达,进行单个/一对 PTFs敲除实验。序列FC分析表明单个PTF的KD对细胞增值无影响,但某些PTF组合的KD降低了该细胞系的增值,但该影响可通过单个PTF表达来挽救(图3.e和f)。两种不同PTFs KD在体内也能显著抑制肿瘤生长速度和延长生存时间(图3.g和h)。这些结果表明,PTFs在体外和体内都以部分重叠的方式维持Yap非依赖性PDAC肿瘤细胞的生长。
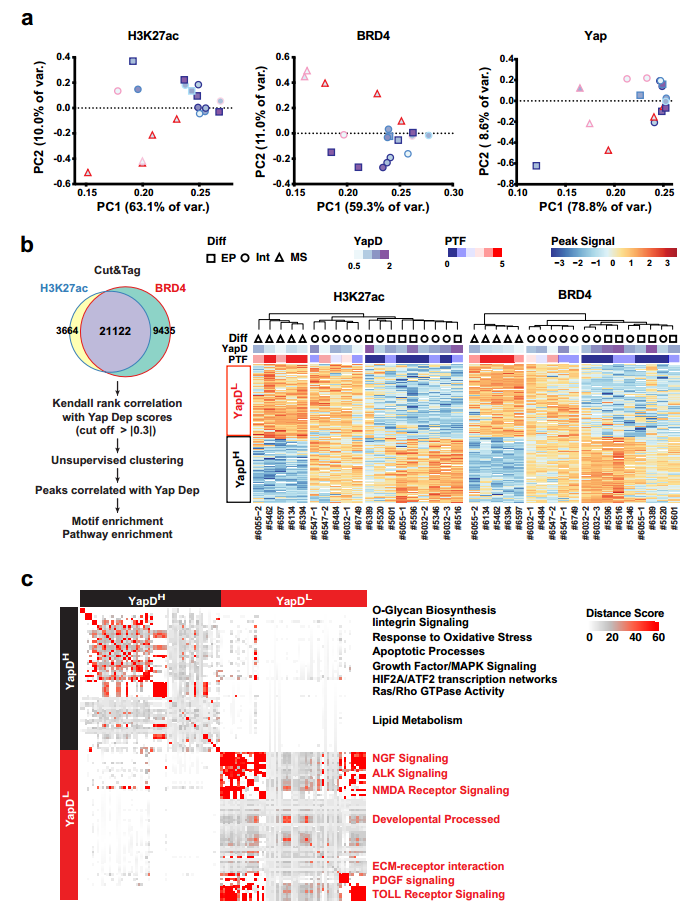
图3. PTF表达与EMT和对Yap消融的抵抗有关。 6. PTF表达和Yap独立性的获得与全局表观遗传重编程有关 实验表明PTF的细胞往往出现在晚期小鼠和人类PDAC肿瘤的坏死边缘或侵袭边缘附近(图2)。基于此,作者提出假设:由p53失活和TME应激诱导的表观遗传重编程可能导致PDAC细胞亚群中PTF的自发再激活。为了进行验证,作者对PTF-low (#6389和#6516)细胞系进行不同的表观遗传酶抑制剂处理,并对Sox2, Sox5和Twist2进行IF分析。结果显示大多数应激条件诱导3种PTF在至少一/两种细胞系中的激活。此外,充分营养条件下,表现出相似的结果,表明表观遗传重编程参与激活PTF。 进一步对19个原代细胞系中的H3K27ac、Brd4和Yap进行 Cut&Tag。无监督聚类和主成分分析表明标记活性增强子和启动子的 H3K27ac 和 Brd4的总体信号谱清晰分离出高PTF 和低 Yap 依赖性的间质PDAC细胞(图4.a)。此外Yap信号的无监督聚类进一步表明PDAC细胞系中Yap结合强度的变化在很大程度上与Brd4和H3K27ac的变化一致(图4.b),这表明与PTF表达和EMT相关的全局表观遗传重编程可能是减少PDAC细胞对Yap依赖的原因。 使用GREAT对Yap依耐性相关的增强子和启动子附近相关的基因进行GO分析,发现与O-聚糖生物合成、整合素信号传导、氧化应激反应、凋亡过程、生长因子/MAPK信号传导、HIF2A/ATF2转录网络、Ras/Rho GTPase活性和脂质代谢相关的基因在Yap依赖性PDAC细胞中高度活跃的基因组区域中显著过度代表。Yap非依赖性PDAC细胞中特异性激活的基因组区域则富含与NGF信号、ALK信号、NMDA受体信号、发育过程、ECM受体相互作用、PDGF信号和TOLL受体信号相关的基因(图4.c)。
图4. PTF表达和Yap独立性的获得与全球表观遗传重编程相关。 7. PTF和Jun共同占据与Yap独立性相关的活性增强子和启动子 HOMER分析表明主上皮谱系TF HNF1b和HNF1a分别识别的同源结构域和核受体基序在与Yap依赖性相关的增强子和启动子处优先富集。而TF家族AP-1(bZIP)等识别基序与Yap独立相关的增强子和启动子中普遍存在。Jun突变体(JunDN)阻断所有AP-1 TF家族成员,显著降低细胞系#5462(Yap不依赖)、#6389和#6516(Yap依赖)中PDAC原代细胞的增殖(图3.e)。 PTF如何与AP-1 TFs协同指导PDAC细胞表观遗传重编程。作者在#5462(Yap不依赖、高水平PTF和Jun)和#6547-1(Yap依赖、低水平PTF和Jun)细胞系中进行Sox2、Sox5、Twist2和Jun的 Cut&Tag。实验表明#5462的4种TF表达水平和各自典型基元位点周围的特异富集读密度均表现出更高的总体染色质结合(图5.b)。至少一种抗体识别的基因组位点分为H3K4me3+TSS和H3K4me3− Cre,44%的TSS和24%CRE位点为H3K27ac、BRD4阳性,最有可能参与主动转录(图5.a)。在活性TSS和CRE位点中,所有4种或3种TFs分别占据45-26%和42-26%,大于90%的独特Jun、Sox2、Sox5或Twist2峰与非活性CRE位点重合(图5.c)。#5462中,至少有三种TFs结合的活性TSS和CRE位点包含76%与低Yap依赖性相关的基因组位点,而79%与高Yap依赖性相关的基因组位点不与四种TFs结合(图5d, e), 92%与至少一种Jun/ PTF共结合, 61%与所有四种tf结合(图5.g)。因此,PTF和Jun共同发挥作用,维持激活的转录,减少PDAC细胞对Yap的依赖,维持转录稳态。
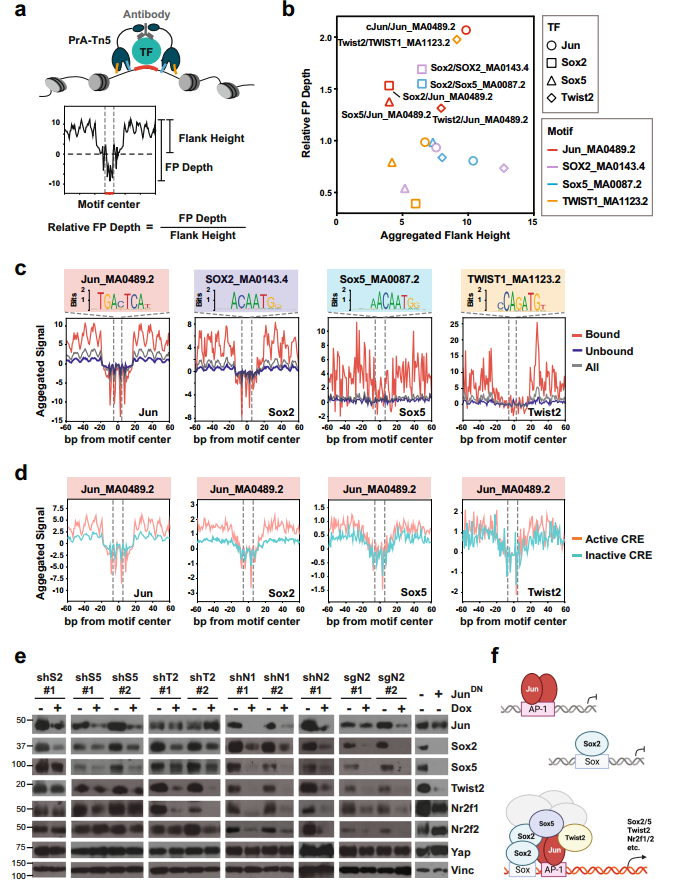
图5. PTF和Jun共同占据与Yap独立性相关的活性增强子和启动子。 8. 在Yap非依赖PDAC细胞中,PTF与JUN形成CRC 为了确定PTF和Jun是如何在Yap不依赖的PDAC细胞中被招募到并维持活性CRE。差异HOMER分析表明发现AP-1基序是所有四个TF活性位点中代表性最大的基序。 TF足迹常用参数“侧翼可达性”和“足迹深度”,分别反应位点周围存在的TF数量和TF在位点的结合轻度。通过TOBISA分析表明Jun和Sox2的侧翼可达性高,核心基序序列的保护能力强,而Sox5和Twist2在结合位点的结合较弱(图6.b和c)。此外,4种TF表现出与典型基序的直接结合,但只有Jun将其他PTF招募到其直接结合位点(图6.b-d)。PTF的共同募集增强了JUN与AP-1位点的结合。 对单个PTF敲低或过表达显性阴性Jun突变体的#5462细胞进行WB分析显示,抑制单个PTF或Jun足以降低其他PTF或Jun的表达(图6.e)。所以,PDAC进展过程中减少PDAC细胞对Yap依赖性的Cre首先由AP-1 TFs直接结合到它们的典型结合位点引发;随后,PTF被招募到AP-1位点和相邻的Sox位点,以及较小程度上的Twist位点,从而稳定AP-1/PTF转录复合物,并增强这些位点和下游靶基因的逐步激活(图6.f)。
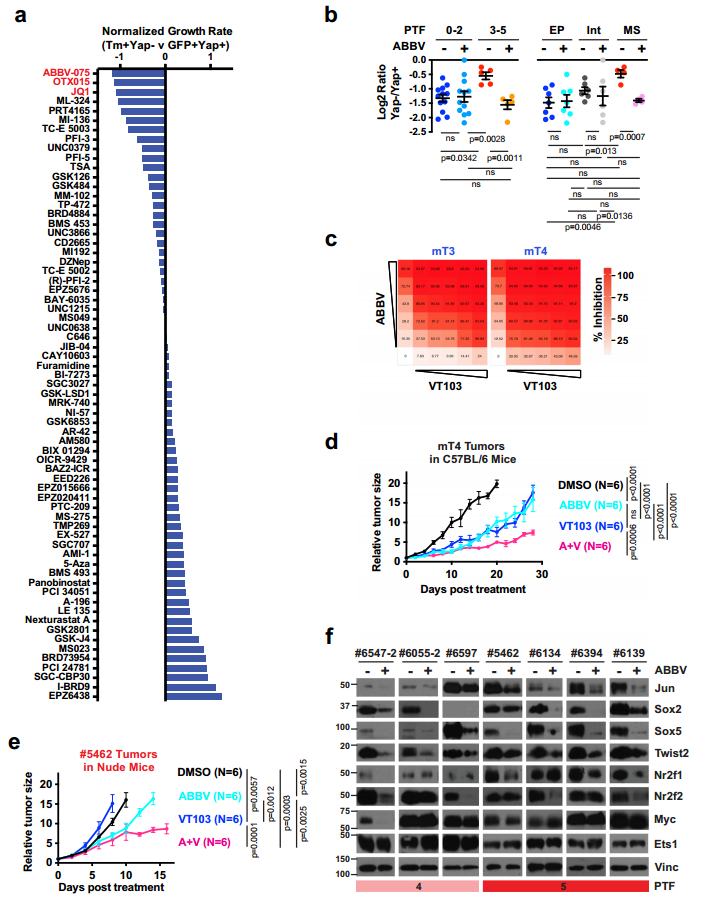
图6. PTF和Jun形成一个CRC,其中Jun是Yap非依赖性PDAC细胞中的显性染色质锚。 9. 溴结构域和外端基序抑制剂(BET - i)阻断PTFs的表达并使PDAC细胞对Yap抑制敏感 为了差别地鉴定阻止对Yap抑制产生耐药性的潜在表观遗传学调节因子。作者在载体对照或各种表观遗传抑制剂存在的情况下进行了长期的Yap依赖性试验。基于#5346发现(1)Yap KO后,其增殖率迅速下降,但随着时间的推移,恢复到与亲代细胞相似的速率与体内复发发展类似(2)Yap-KO细胞中细胞增殖的恢复伴随着PTFs的上调。此外在人细胞系中显示出对Yap的直接依赖性,并适应Yap损失。因此两个细胞系中BET - i连续得分最高,阻止Yap独立种群生长(图7.a)。此外,在低剂量BET抑制剂ABBV-075存在下的短期Yap依赖性试验发现:虽然ABBV-075治疗没有增强急性Yap丢失对低PTF评分的上皮PDAC细胞的生长抑制作用,但它显著增高PTF评分的中间质PDAC细胞对Yap消融的敏感。 此外,#6516细胞(Yap依赖性)中Yap Cut&Tag峰足迹分析证实了Yap与TEAD和AP-1位点的强结合。VT103和ABBV-075(阻断YaP/TEAD相互作用的TEAD棕榈酰化抑制剂)在体外强烈协同抑制这两种细胞系(KrasG12D:Trp53R172H:PdxCre (KPC)小鼠回交得到的mT3和mT4)的增殖(图7.c)。同样,VT103和ABBV-075联合治疗进一步延缓免疫活性C57BL/6小鼠mT4皮下肿瘤的生长、延长生存期(图7.d)。 对携带#5462异种移植瘤的裸鼠用载体对照组VT103、ABBV-075或ABBV-075+VT103进行处理。发现ABBV-075或ABBV-075+VT103治疗使肿瘤生长速度减慢 (图7.E)。有趣的是,尽管联合治疗最初导致的肿瘤生长延迟与ABBV-075单一治疗相似,但随着时间的推移,它导致了更持久的肿瘤控制(图7.E),这表明ABBV-075治疗可能会使Yap非依赖性PDAC肿瘤对YAP/TEAD抑制剂重新敏感。在机制上,实验发现ABBV-075诱导Yap不依赖于Yap的PDAC细胞对YAP的遗传或药物抑制重新敏感,同时在体外和体内都伴随着PTF的强烈下调(图7.F)。 综上所述,这些结果表明BRD4是促进PTF表达所必需的,BET-I可能被用来预防或克服对Yap抑制的抗性。
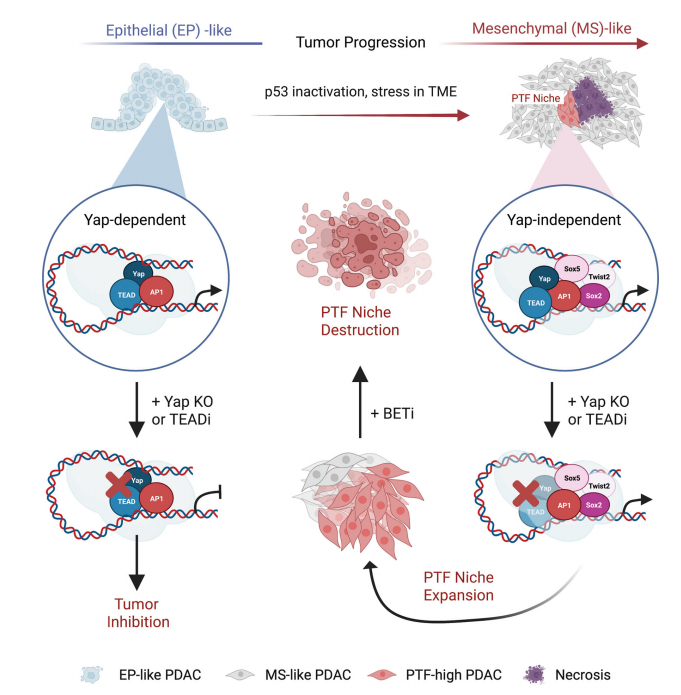
图7. BET抑制剂阻断PTF的表达并使PDAC细胞对Yap抑制敏感。 谱系可塑性已被认为是肿瘤内异质性和治疗抵抗的主要来源。作者阐明谱系可塑性在晚期PDAC肿瘤在消除中心致癌驱动基因Yap后发生自发复发的机制。实验表明Jun与PTF Sox2/5、Twist2、Nr2f1/2形成相互连接的前馈转录环,并招募PTF激活与Yap非依赖性相关的SEs。此外,单独的PTF或Jun单独占据的CRE在很大程度上没有H3K27乙酰化和Brd4结合,这表明PTF和Jun之间的协同作用是维持YAP非依赖性PDAC细胞活跃转录所必需的(图8)。
图8. 模型图。 原文链接:https://rdcu.be/djH5y 了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |