NEWS
新闻资讯
|
Cell Reports | 揭开METTL14在介导m6A修饰中的神秘面纱m6A被认为是最丰富的mRNA修饰,广泛分布在大多数真核生物中,包括哺乳动物、植物、昆虫、酵母和某些病毒。m6A修饰的沉积和去除之间的动态平衡对于正常的生物过程和发育至关重要,如失调通常与癌症等疾有关。m6A修饰由m6A甲基转 移酶复合物(MTC)执行,包括METTL3、METTL14、WTAP等。METTL3在1997年被发现,其异常表达通常会影响 m6A甲基化,METTL14 被认为是一种催化不活跃的适配蛋白,可帮助 METTL3与RNA结合,但METTL14如何帮助识别m6A修饰靶标仍不清楚。 今天,通过一篇文章为大家介绍一下METTL14在介导m6A 修饰靶标识别中的作用。这篇题为《A cancer-associated METTL14 mutation induces aberrant m6A modification, affecting tumor growth》的文章在今年7月份发表于Cell Reports杂志上,该文章研究了METTL14 R298P突变影响m6A的修饰平衡,从而影响相应mRNA稳定性和癌细胞增殖的相应机制。
发表单位:大阪大学医学院 发表日期:2023年7月25日 期 刊 :Cell Reports(IF: 8.8) 01 研究背景 RNA在转录后受到各种修饰,这些修饰决定了它的命运。这些修饰之一是N6甲基腺苷(m6A),它广泛存在于哺乳动物的mRNAs中。异常的m6A修饰与包括癌症在内的许多疾病的发生和进展有关。METTL3/METTL14复合体主要催化m6A修饰,从而影响mRNA的稳定性。虽然METTL14 R298P突变在多种癌症类型中被发现,但其生物学效应并不完全清楚。 02 研究亮点
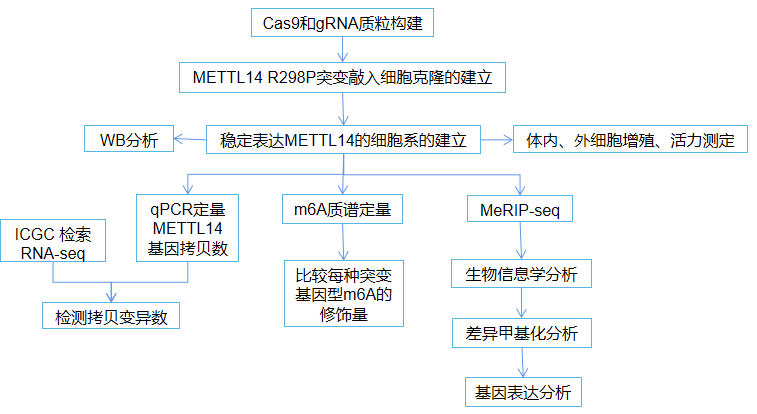
03 研究思路
04 研究结果 1. 杂合和纯合的METTL14 R298P突变对癌细胞增殖的影响相反 为了研究癌症相关的METTL14 R298P突变如何影响m6A甲基化模式及其生物学后果,作者首先利用基于CRISPR-Cas9的同源重组建立了含有METTL14 R298P突变的子宫内膜癌细胞系(HEC108),并成功地获得了多个在杂合条件(METTL14+/Mu)或纯合条件(METTL14Mu/Mu)以及插入沉默突变(SMs)以增加同源重组的子宫内膜癌细胞株(HEC108)。作者观察到,METTL14 R298P突变并不影响METTL14或METTL3的蛋白表达(图1D)。此外,根据公共数据库显示 HEC108 细胞中 METTL14 的拷贝数为两个,作者观察到他们建立的 METTL14突变的 HEC108 细胞系也携带两个拷贝的METTL14 基因(图1E和1F)。
图1. 基因组编辑技术构建METTL14 R298P突变子宫内膜癌细胞系。 然后,作者评估了 METTL14 R298P 突变在体外和体内对细胞增殖的影响。与野生型(METTL14+/+)细胞相比,携带METTL14+/Mu突变的 HEC108细胞在体外显示出更高的细胞增殖率(图 2A)。相比之下,METTL14Mu/Mu突变则显著降低了细胞增殖率,所有受检克隆都观察到了类似的结果。作者通过在HEC108细胞中单独表达含有SMs的METTL14转基因的METTL14蛋白来检测SMs的作用。这些分析显示,SMs不影响蛋白表达和细胞活力,这表明细胞增殖率的差异是由杂合和纯合R298P突变引起的,而不是SMs。为了在体内评估这种差异,通过向裸鼠皮下注射HEC108细胞建立了异种移植小鼠模型。他们观察到METTL14+/Mu细胞形成的肿瘤明显大于METTL14+/+细胞,而携带METTL14Mu/Mu突变的细胞形成的肿瘤明显较小(图2B)。此外,当小鼠腹腔注射METTL14+/Mu细胞时,METTL14+/Mu细胞形成明显更多的腹膜肿瘤,而METTL14Mu/Mu细胞形成的肿瘤明显减少(图2C)。 接下来,作者从ICGC中检索了RNA-seq结果,并确定了癌症患者中METTL14突变的杂合度。他们在这些患者中没有观察到METTL14基因的拷贝数改变,相比之下,在大多数情况下,METTL14 R298P和R298H突变的等位基因频率都小于50%,这意味着该突变在大多数癌症样本中是杂合的(图2D)。综上所述,这些数据表明,在癌症样本中发现的杂合状态下的METTL14 R298P突变促进了致瘤性,而在纯合状态下,它对癌症进展具有抑制作用。
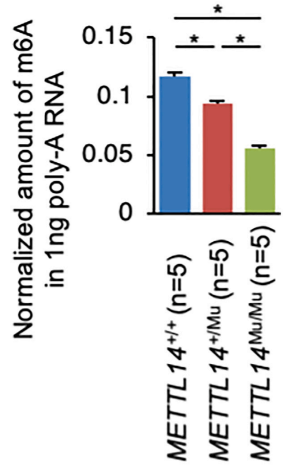
图2. 杂合和纯合METTL14 R298P突变对癌细胞增殖的相反作用。 2. METTL14 R298P突变减少了m6A修饰 为了阐明METTL14+/Mu和METTL14Mu/Mu突变对癌细胞增殖产生相反影响的分子机制,作者比较了每种基因型中m6A的修饰量。质谱分析表明,METTL14+/Mu细胞中m6A修饰水平显著降低,METTL14Mu/Mu细胞中m6A修饰水平进一步降低(图3),并且进一步证实了SMs不影响m6A的修饰。这些结果表明,METTL14 R298P突变以突变蛋白剂量依赖的方式降低了m6A修饰的总水平。然而,简单的酶活性或靶点识别的丧失不太可能是导致METTL14+/Mu和METTL14Mu/Mu细胞增殖率差异的唯一原因。
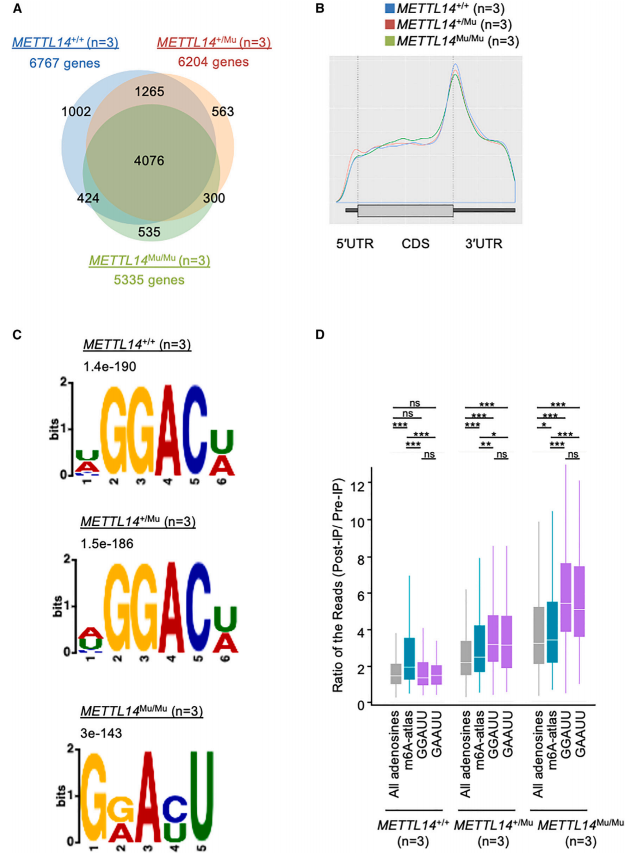
图3. METTL14 R298P突变减少子宫内膜癌细胞系中m6A修饰。 3. 突变体METTL14(R298P)识别m6A修饰的异常基序 鉴于METTL14在靶标识别中发挥作用,作者接下来研究了R298P突变是否影响了m6A修饰模式。作者进行了MeRIP-seq分析,通过使用抗m6A抗体进行RNA免疫沉淀,将m6A修饰位点识别为测序reads高度的增加(即峰)。这些分析表明,大多数靶基因在METTL14+/+、METTL14+/Mu和METTL14Mu/Mu细胞中大部分是共享的(图4A)。此外,所有三种基因型的MeRIP-seq峰在终止密码子周围高度富集(图4B),这种分布模式与先前的MeRIP-seq研究相似。然而,尽管与已知的m6A修饰位点的典型基序相对应的[U/A/C]GGAC[U/A] (=HGGACW)序列基序通常富集在METTL14+/+和METTL14+/Mu细胞源性RNA的峰中,但在METTL14Mu/Mu细胞源性RNA的峰中检测到一个不同的基序,即G[G/A]A[C/U]U (=GRAYU)(图4C)。在这个基序中,靶向A的3’侧是C和U的混合物,目前还没有报道。然而,CentriMo分析显示,该异常基序位于MeRIP-seq峰的中心区域,与METTL14+/+和METTL14+/Mu样品中的典型基序相似,这支持了作者分析的稳健性。这些结果表明R298P突变可能改变了METTL14的靶标识别。 作者进一步分析了突变体METTL14识别基序,通过使用exomePeak和MetDiff分析,重点研究了每种基因型之间甲基化差异的MeRIP-seq峰。exomePeak分析表明,与METTL14Mu/Mu细胞相比,METTL14+/+和METTL14+/Mu细胞中甲基化程度较高的峰中显著富集了典型的含5’-AC-3’基序。相反,与METTL14+/+细胞相比,METTL14Mu/Mu细胞中甲基化程度更高的296个峰中富集了异常的5’ -AU-3’基序。在这296个峰中,m6A-Atlas数据库记录了512个典型的m6A修饰位点。在这些位点,无论 METTL14的基因型如何,用抗m6A 抗体进行 RNA 免疫沉淀获得的测序reads的平均深度都明显高于所有腺苷的平均深度,这表明这些典型位点仍可被突变体 METTL14(R298P)甲基化(图4D)。相比之下,在METTL14+/Mu样品中,在GGAUU和GAAUU基序的腺苷上的免疫沉淀测序reads的平均深度显著富集,而在METTL14+/+样品中没有观察到这一点。这种富集在METTL14Mu/Mu样品中进一步增强(图4D)。此外,MetDiff分析比exomePeak检测到更多的差异甲基化峰,该分析显示在METTL14Mu/Mu细胞中甲基化程度较低的峰中再次检测到典型的含有5’ -AC-3’的基序,而在METTL14Mu/Mu细胞中甲基化程度较高的峰中富集了异常的5’ -AU-3’基序。综上所述,这些数据表明,虽然METTL14 (R298P)可以在一定程度上识别典型基序,但该突变蛋白也会甲基化异常基序5’-AU-3’中的腺苷。
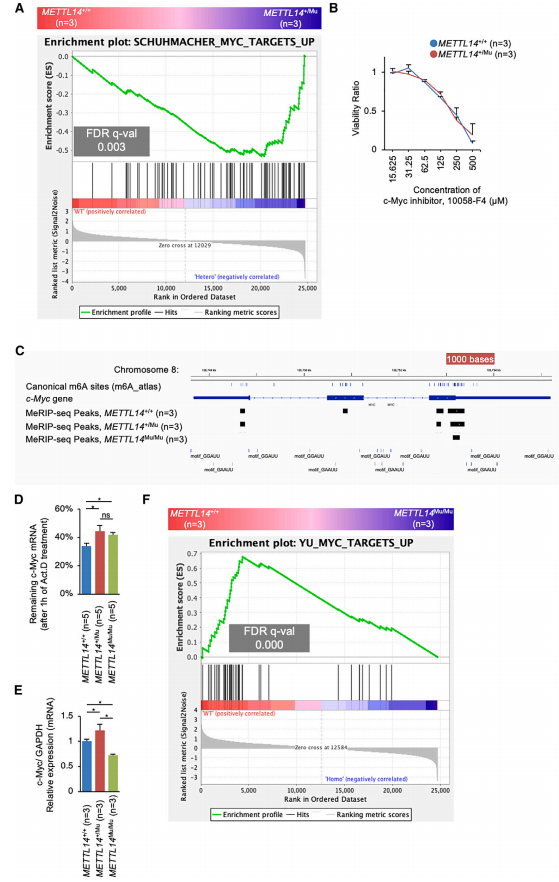
图4. METTL14 R298P纯合突变诱导的靶标异常识别。 4. 尽管m6A修饰减少,但METTL14Mu/Mu细胞中c-Myc mRNA的表达降低 为了鉴定受m6A修饰调控并参与细胞增殖分子通路的基因,作者使用基因集富集分析(GSEA)比较了METTL14不同基因型之间的基因表达。该分析显示,与METTL14+/+细胞相比,METTL14+/Mu细胞中原癌基因c-Myc靶向基因的表达水平显著升高(图5A)。c-Myc抑制剂以剂量依赖性的方式降低了HEC108细胞的活力,这表明c-Myc有助于这些细胞的增殖(图5B)。已知c-Myc mRNA的表达受m6A修饰的控制,作者在MeRIP-seq分析中观察到多个甲基化峰,其中包括典型位点(图5C)。 为了研究HEC108细胞中c-Myc mRNA的稳定性是否受m6A修饰的调控,测量了加入放线菌素D (Act.D)抑制转录后c-Myc mRNA的降解率。该分析表明,METTL14+/Mu和METTL14Mu/Mu细胞中的降解率都显著降低(图5D),这表明METTL14 (R298P)突变导致的m6A修饰的减少而稳定了c-Myc mRNA。然而,尽管c-Myc mRNA在METTL14+/Mu细胞中表达显著增加,但在METTL14Mu/Mu细胞中表达降低(图5E)。相应地,GSEA显示,与METTL14+/+细胞相比,c-Myc靶向基因在METTL14Mu/Mu细胞中的表达水平显著降低(图5F)。总之,这些数据表明,m6A修饰减少可以稳定c-Myc mRNA,这可能是导致METTL14+/Mu细胞增殖增加的原因之一,而c-Myc mRNA表达降低的某种机制很可能主导了m6A修饰对METTL14Mu/Mu细胞c-Myc mRNA的影响。
图5. METTL14 R298P 突变使c-Myc mRNA稳定。 5. 异常的m6A修饰会破坏c-MET mRNA的稳定性,导致c-Myc的表达减少 为了研究异常识别基序上m6A修饰对基因表达的影响,作者比较了METTL14+/+和METTL14Mu/Mu细胞中含有差异甲基化峰的基因的表达水平。与METTL14Mu/Mu细胞相比,METTL14+/+细胞中甲基化程度较高的峰的基因显著上调(图6A)。然而,没有观察到突变体METTL14 (R298P)识别的富含异常基序的峰的基因的类似差异。因此,作者进一步将METTL14Mu/Mu细胞中甲基化程度较高的峰的基因(285个基因)分为具有典型m6A位点(174个基因)和不具有典型m6A位点(111个基因)两个亚组,并分析相应基因的表达情况,发现具有典型m6A位点的基因表达水平显著降低(图6B)。这些数据表明,异常的m6A修饰可能会改变典型基序的甲基化效率,影响相应mRNA的稳定性。
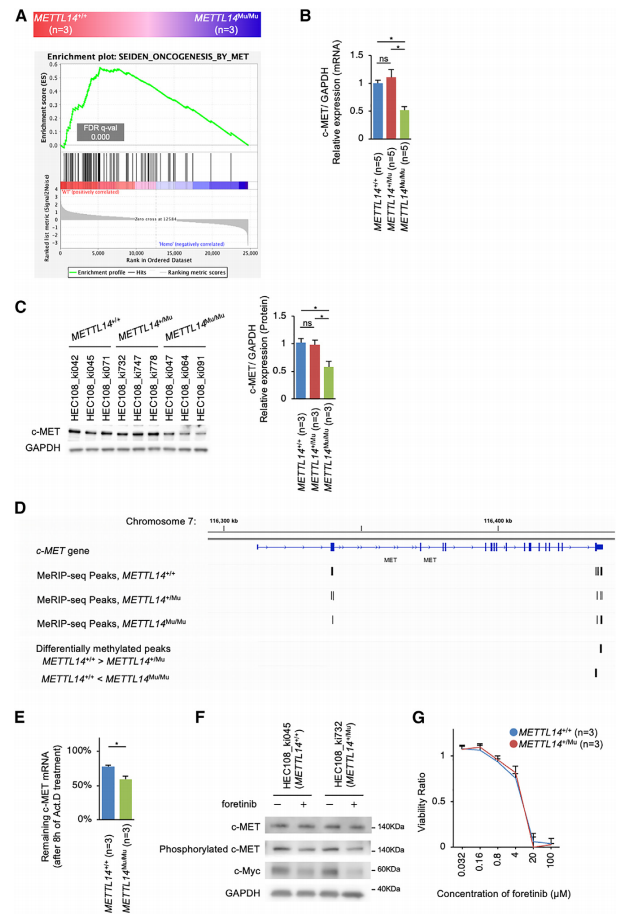
图6. 突变体METTL14 (R298P)介导的异常m6A修饰降低了存在典型m6A位点的基因表达。 为了确定受m6A异常修饰影响并参与c-Myc上游信号通路的基因,作者重点研究了c-MET,这是另一种受m6A修饰调节的原癌基因,已知在子宫内膜癌中起关键作用。根据GSEA显示,在METTL14Mu/Mu细胞中,c-MET靶标的表达强烈下调(图7A),因此,METTL14Mu/Mu中c-MET mRNA的表达显着降低,导致c-MET蛋白表达降低(图7B和7C),在METTL14+/Mu细胞中未观察到这种变化。有趣的是,exomePeak分析检测到,与 METTL14+/+细胞相比,METTL14Mu/Mu细胞在终止密码子周围的 MeRIP-seq 峰甲基化程度更高,其中包括四个异常基序(图7D)。 为了研究 m6A 修饰在异常基序中的作用,作者首先使用c-MET mRNA中含有异常基序 (5’-GGAUU-3’ ) 的 RNA 探针进行电泳迁移率变动测定 (EMSA)。该分析表明,与典型基序 (5’-GGACU-3’) 中的 m6A 相比,异常基序中的m6A较少被代表性 m6A 阅读器蛋白 YTHDF2 识别。因此,异常基序中的m6A修饰会促进阅读器蛋白被招募至相应 mRNA上的说法不太可信。接下来,作者检查了每个位点的甲基化效率,发现在异常位点上的 m6A 修饰会提高周围典型基序的甲基化效率。为了验证这一观察结果,作者采用了基于单碱基伸长和连接的 PCR 扩增法(SELECT)检测这些位点的 m6A 修饰水平。这项分析表明,与METTL14+/+ 细胞相比,METTL14Mu/Mu细胞中c-MET mRNA异常基序中的腺苷被高度甲基化。与此同时,在METTL14Mu/Mu细胞中,周围典型基序的腺苷也被更多地甲基化。 作者通过添加Act.D抑制转录后测定c-MET mRNA的降解率,分析表明,METTL14Mu/Mu细胞的c-MET mRNA降解率显著增加(图7E)。此外,c-MET抑制剂foretinib的加入降低了METTL14+/+和METTL14+/Mu细胞中的c-Myc表达和细胞活力(图7F和7G)。总之,在靠近异常 m6A 修饰位点的典型基序上,甲基化效率的提高很可能会促进 c-MET mRNA的不稳定,从而导致c-Myc的表达减少,并抑制METTL14Mu/Mu细胞的增殖。
图7. 突变METTL14介导的异常m6A修饰使c-MET mRNA不稳定 在这里,作者发现,与癌症相关的METTL14 R298P突变不仅降低了典型位点的甲基化效果,而且还诱导了异常基序上的m6A修饰。这种异常修饰改变了周围典型位点的甲基化模式,从而影响mRNA的稳定性和癌细胞的增殖。然而,这项研究表明,要估计失调的m6A修饰对疾病发病机理的影响十分困难,因为这取决于个体m6A修饰的微妙平衡。因此,确定受m6A修饰控制的关键基因并确定其对癌症进展的影响,对于制定针对m6A修饰的治疗策略至关重要。
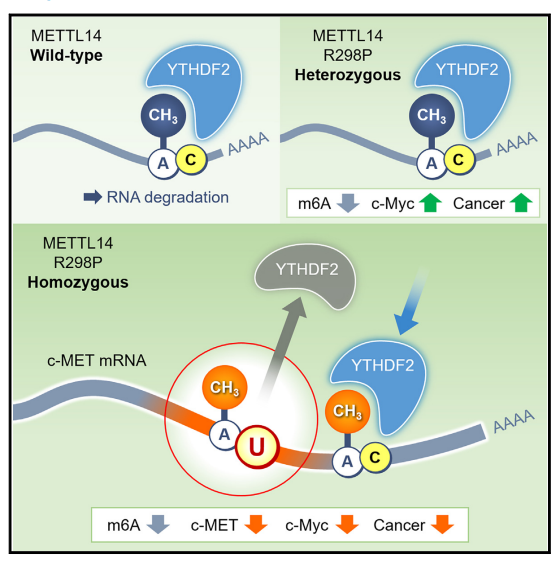
图8. METTL14 R298P突变影响m6A修饰的靶标识别从而干扰癌细胞增殖的模型图。 原文链接:https://doi.org/10.1016/j.celrep.2023.112688 爱基百客专注于提供领先的表观组学服务,可提供方案设计、样本制备、测序、分析以及验证一站式服务。 九月开学季,科研新起点!爱基百客带着表观产品前来助力!部分产品低至8折!活动期间,表观产品全线优惠,欢迎咨询。
了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |