NEWS
新闻资讯
|
Science adv | 转录因子SPIC连接胚胎干细胞中的细胞代谢与表观调控代谢是生化反应网络的结果,这些反应吸收营养物质并对其进行处理,以满足细胞的需求,包括能量产生和生物合成。反应的中间体被用作各种表观基因组修饰酶的底物和辅助因子,因此代谢与表观遗传密切相关。代谢结合表观遗传涉及疾病,癌症和发育等多方面。今天我们来看看在胚胎干细胞中E26 转化特异性(ETS)TFs家族的Spic如何影响代谢与组蛋白修饰。
2023年贝尔法斯特女王大学的Yaser Atlasi教授研究团队在期刊Science advances(IF:13.6)发表了题为“Spic regulates one-carbon metabolism and histone methylation in ground-state pluripotency”的研究论文。该研究结果表明:Spic控制单碳代谢和S-腺苷蛋氨酸到S-腺苷-L-高半胱氨酸(SAM-to-SAH)的流动,从而调节着胚胎干细胞(ESCs)中H3R17me2和H3K4me3组蛋白标记的水平。该研究通过Spic的功能将细胞代谢与ESCs中的表观遗传调控联系起来。
研 究 背 景早期胚胎发育过程中,细胞经历一系列多能状态,其中一些在体外特定培养条件下被捕获为胚胎干细胞(ESCs),不同的外界因子刺激分化为不同的类型。而了解ESCs的表观遗传调控机制对干细胞和发育生物学至关重要。作者对ESCs 不同状态之间的时间转录和表观遗传变化进行检测,指出 Spic 是 2iL-ESC 中最早的诱导基因之一,是E26 转化特异性(ETS) TFs家族一员。其在免疫背景下已有相关研究,但Spic在胚胎干细胞和早期胚胎发育中的作用仍然未知。
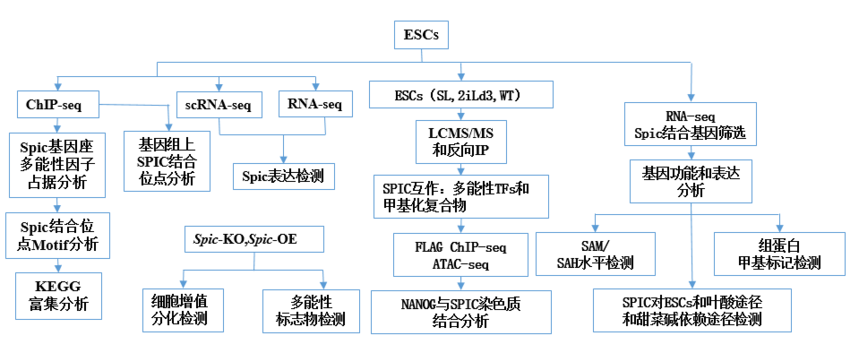
研 究 思 路
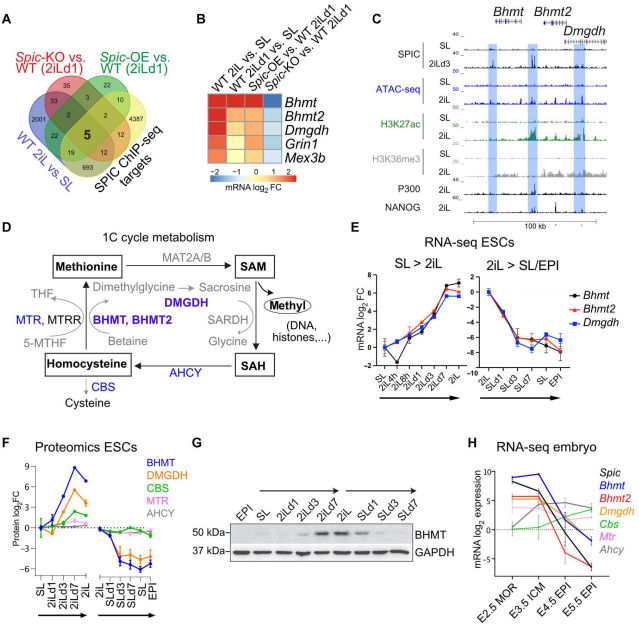
研 究 结 果1. Spic表达标志着基态多能性 作者对维持在不同多能状态下的mESCs转录谱进行分析。结果显示:Spic在2iL-ESCs中高表达,SL-ESCs中迅速下调,EPI-ESCs中完全抑制(图1.A)。SL-ESCs和2iL-ESCs的单细胞RNA-seq数据进一步证实Spic在SL-ESCs中不表达(图1.B)。小鼠着床前胚胎RNA-seq数据显示Spic在四细胞、八细胞和ICM胚胎阶段高表达,在着床后的外胚层细胞中急剧下调(图1.C)。 由于2iL培养基具有两种激酶抑制剂(CHIR99021、PD0325901)。作者接下来在单一抑制剂培养基中进行ESCs培养,实验表明Spic主要由PD0325901处理诱导,这表明Spic受MEK/细胞外信号调节激酶(ERK)信号的负调控(图1.D)。已发表ChIP-seq数据也证实2iL 和 PD0325901 处理ESCs,ERK 与Spic 启动子结合减少。此外,在2iL-ESCs中,Spic位点被多能性相关的TFs占据,包括OCT4、SOX2、NANOG、ESRRB、KLF4和NR5A2 (图1.E)。 作者下一步研究了2iLESCs 中SPIC在全基因组上的结合。构建表达SPIC-GFP BACs的ESCs,作者对SL或SL-to-2iL转换3天(2iLd3)培养的ESC进行了GFP-ChIP-seq检测SPIC ChIP-seq 峰基序分析显示, ETS 基序高度富集,证实ChIP-seq 数据的特异性(图 1.F)。基因GO富集分析表明,SPIC结合位点位于多能性相关基因附近(图1.G,H)。此外,大多数SPIC峰位于基因间区(~60%)或内含子区(38%;图1.I),其特征是H3K4me1/2和H3K27ac增强子标记水平高,H3K4me3水平低,H3K9me3和H3K27me3抑制标记缺失(图1.J)。 综上所述,SPIC是基态多能性的特定标记物,它与ESC多能性相关的活性基因的远端调控元件结合。
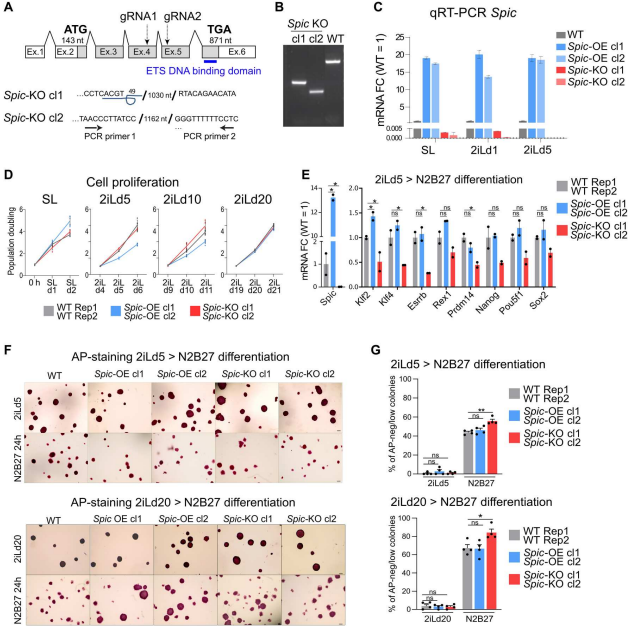
图1. Spic是基态多能性的特殊标记物 2. SPIC稳定NANOG与单碳代谢相关基因的结合 为了研究Spic在基态多能性中的作用。作者使用CRISPR-Cas9和 SPIC-GFP BACs分别构建Spic 基因敲除和过表达的ESCs,即Spic-KO和Spic-OE。每个基因型选择两个独立的 ESC 克隆进行下游分析(图 2.A-C)。在 SL 和 2iL下,Spic-KO 和 Spic-OE ESCs都能保持正常的形态、增殖率和关键多能性标记物的表达,这表明 Spic 对 ESC 的维持并非不可或缺(图 2.D),但Spic减弱了从基态多能性的早期退出。N2B27 培养基的ESCs分化、多能性标记物qRT-PCR、AP染色实验和不同ESCs分化后AP-low 统计数据表明Spic-KO细胞分化能力加快(图2.E-G)。因此,Spic支持2iL状态的细胞,但不是维持基态多能性所必需的。
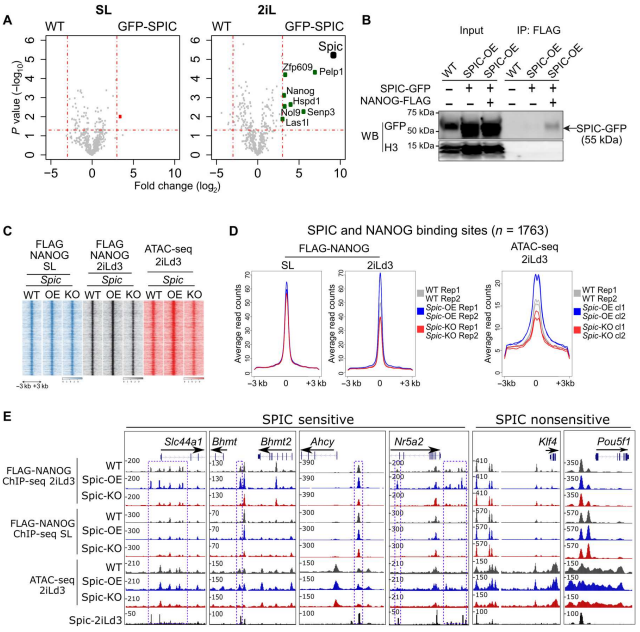
图2. SPIC支持2iL-ESCS,但对ESC维持不是必需的 为了明确SPIC在2iL-ESCs中的作用。作者以WT ESCs为阴性对照,SL或2iLd3中培养SPIC-GFP ESCs。通过LC-MS/MS分析蛋白相互作用,结果表明2iL-ESCs中检测到几种SPIC相互作用物,包括多能性TFs NANOG和ZFP609以及甲基化Chtop (5FMC)蛋白复合体的几个成员:PELP1、SENP3、NOL9和LAS1L1 (图3.A)。作者进一步通过反向IP表达FLAG-NANOG或FLAG-PELP1的构建,SPIC-GFP的免疫印迹进一步证实Top候选基因的相互作用(图3.B)。 由于检测到NANOG在SPIC结合位点的高度共占位。作者下一步对SPIC 如何影响 NANOG 与染色质结合进行评估。首先,在Spic-WT、Spic-OE和Spic-KO ESCs中表达FLAG-NANOG,并通过FLAG ChIP-seq检测NANOG与染色质的结合情况(图3.C,D),结果证实了共占位分析,并且对 SPIC 缺失敏感的 NANOG 结合位点主要位于参与胆碱/单碳代谢的基因附近( Slc44a1、Bhmt 、 Ahcy)。由于这些位点在SL-ESCs中NANOG结合不受影响,因此SPIC对2iL-ESCs具有特异性作用(图3.E)。ATAC-seq数据表明Spic过表达或缺失分别导致 SPIC-NANOG 结合位点的染色质可及性增加和降低(图 3.D , E)。因此,SPIC 可稳定 NANOG 与主要与胆碱/单碳代谢相关的特定调控元件的结合。
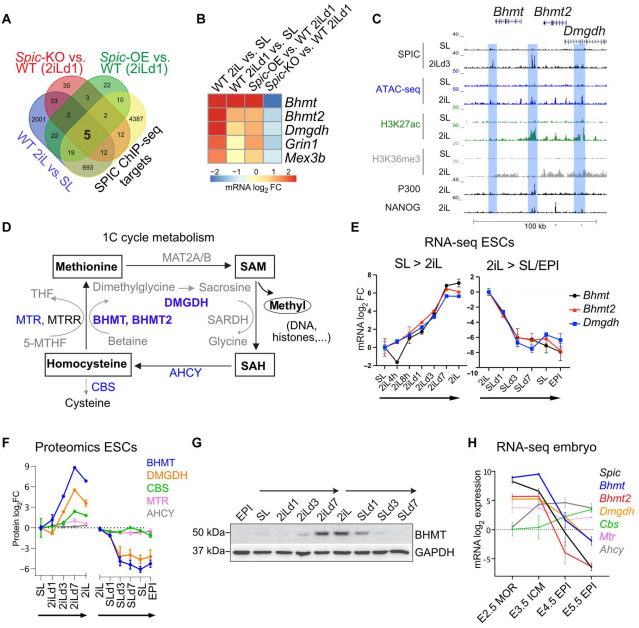
图3. SPIC与NANOG相互作用并稳定其染色质结合 3. SPIC调节单碳代谢 为了探索Spic在分子水平上的作用并捕捉Spic干扰的早期反应。作者对WT ESCs和2iL培养基中培养1天(SL - 2iLD1)的Spic- KO和Spic- OE ESCs进行RNA-seq和差异基因分析,以及分析完全适应 2iL 的 WT ESCs 的表达谱(在 2iL 中培养超过 21 天),选择与 SL-ESCs 相比显示出一致差异表达的基因。最终结合以上选择在其启动子附近100 kb内显示Spic结合的基因(图4.A)。最终找到高度置信的5个基因: Bhmt、Bhmt2、Dmgdh、Grin1和Mex3b——其代表2iL-ESCs对Spic的早期和直接反应(图4.B)。 Spic的三个Top靶蛋白Bhmt、Bhmt2和Dmgdh在基因组中聚集在一起,并且在相邻的增强子上共享多个SPIC结合位点,且在单碳代谢中具有相关功能(图4.C,D)。在大多数细胞中,单碳代谢循环通过蛋氨酸合成酶(MTR)以及叶酸衍生物携带的甲基将同型半胱氨酸转化为蛋氨酸。而在肝脏和早期胚胎中,同型半胱氨酸转化为蛋氨酸的过程也得到了以甜菜碱为甲基供体的BHMT/BHMT2和DMGDH顺序活性的支持[1]。此外,作者观察到Bhmt、Bhmt2和Dmgdh与Spic类似,其在2iL- ESCs中被高度诱导,并在2iL-向SL-EPI转变过程中迅速下调(图4.E-G)。Bhmt、Bhmt2和Dmgdh在着床前胚胎中高表达,在着床后外胚层中下调(图4.H)。
图4. SPIC调节单碳代谢基因 为了建立与Spic的直接联系。作者测量Spic-KO和Spic-OE ESCs中Bhmt、Bhmt2和Dmgdh的水平,结果表明消耗Spic抑制Bhmt、Bhmt2和Dmgdh的表达,而Spic-OE提高了2iL-ESCs中这些基因的水平(图5.A,B)。此外,PD0325901或CHIR99021处理后检测细胞中Bhmt、Bhmt2和Dmgdh水平,这些基因在MEK/ERK抑制的下游被高度诱导(图5.C,D)。值得注意的是,甜菜碱在ESC培养中不补充,但可以从胆碱中产生,胆碱存在于2iL和SL培养基中。作者发现与研究结果一致,胆碱转运蛋白Slc44a1在2iL-ESCs中上调,这表明2iL-ESCs具有更高的胆碱摄取能力。综上所述,这些发现表明Spic在2iL-ESCs中直接激活单碳代谢基因Bhmt、Bhmt2和Dmgdh。 单碳代谢循环通过控制SAM和S-腺苷-L-同型半胱氨酸(SAH)的水平,在表观遗传调控中起着核心作用。作者使用MS,测量SAM和SAH的细胞水平,发现在2IL-ESCs中,Spic的过度表达导致SAM到SAH的流动增加,而Spic的耗尽导致SAM到SAH的转化降低(图5.E)。 SAM是DNA、组蛋白、RNA、脂肪和蛋白质甲基化甲基的通用供体。作者进一步探索Spic是否影响DNA甲基化水平。质谱法测定Spic-OE和Spic- KO ESCs中5mC和5hmC水平,发现Spic对5mC和5hmC水平没有影响。而Western blot分析一组甲基组蛋白标记发现Spic特异性地降低2iL-ESCs中H3K4me3的水平并增加H3R17me2的水平 (图5.F)。因此,PD0325901 (MEK/ERK抑制)降低H3K4me3的水平,增加H3R17me2的水平,进一步将Spic和单碳代谢基因与特定的表观遗传变化联系起来(图5.G)。 在长期2iL培养的ESCs中使用qRT-PCR和免疫印迹法检测Bhmt、Bhmt2和Dmgdh以及这些位点的SPIC结合状况(图5.H)。结果表明在稳态 2iL-ESCs 中,与 Spic-KO ESCs 相比,Spic-OE ESCs 的 SAM/SAH 水平降低,H3R17me2a 水平升高,H3K4me3 的水平无明显差异(图 5.H)。
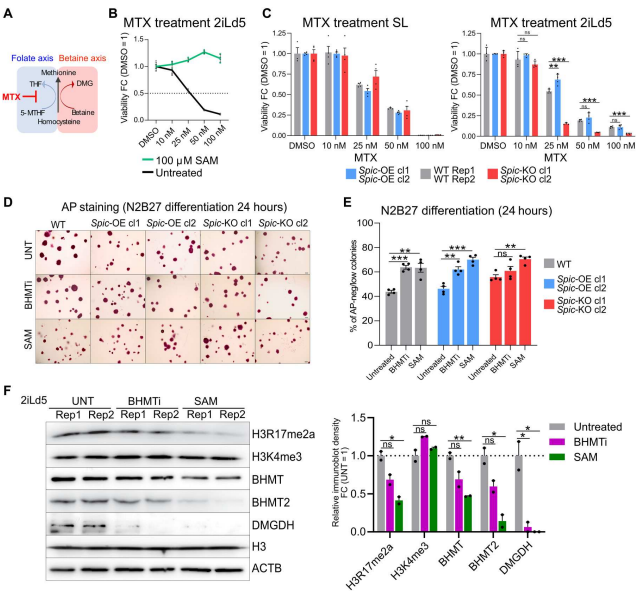
图5. SPIC调节SAM/SAH水平和组蛋白甲基化 甜菜碱依赖途径和叶酸依赖途径之间的合作调节单碳代谢(图 6.A)。作者检测了SPIC对ESCs和叶酸途径的影响。使用叶酸途径抑制剂——氨甲喋呤(MTX),并评估Spic-KO、Spic-OE 和 WT ESCs 对 MTX 处理的反应。实验表明ESCs 补充 SAM 可以完全缓解 MTX 的有害影响(图 6.B)。消耗 Spic 会增强 ESCs 对 MTX 处理的敏感性(图 6.C)。同样,SL-ESCs 表现出较低的甜菜碱依赖性单碳代谢(图 6.B)。这些发现表明,Spic下游甜菜碱依赖的单碳代谢的激活增强了多能细胞对影响叶酸途径的环境扰动的稳健性。
图6. 靶向单碳代谢影响ESCs分化 此外,使用BHMT抑制剂(BHMTi;CBHcy)或通过向ESCs补充外源性SAM。两种处理均表现Spic-KO ESCs: CBHcy抑制BHMT活性,导致SAM- SAH通量降低,而SAM补充直接增加SAM/SAH比率。用BHMTi或SAM处理后,通过AP阳性克隆数量的减少和 naïve 多能标记的表达减少,可以加速ESC的分化(图6.D和E)。BHMTi和SAM处理也降低了H3R17me2a的水平,这一影响在SAM处理中更为明显(图6.F)。
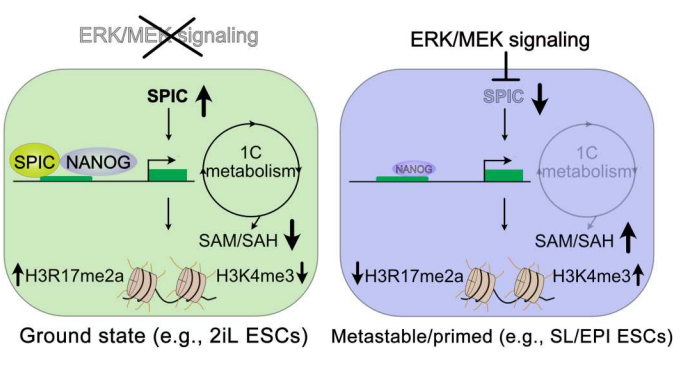
图7. SPIC将细胞新陈代谢与基态多能性的表观遗传调控联系起来 综上所述,在2IL-ESCs中,SPIC在MEK/ERK抑制作用下被诱导,在早期胚泡中表达上调。其稳定NANOG的结合,增加参与胆碱和单碳代谢的基因的染色质可及性,并通过激活甜菜碱依赖的单碳代谢,增加SAM到SAH的流动,维持低水平的SAM,并控制基态ESCs中H3K4me3和H3R17me2的水平,ERK/MEK信号在从基态向原态多能性的转变过程中抑制Spic和单碳的代谢(图7)。
研 究 结 果早期胚胎发育过程中经历一系列多能状态,其中一些在体外特定培养条件下被捕获为胚胎干细胞(ESCs)。ESCs在不同外界因子刺激下分化为不同类型。ESC的状态代表了多能性谱的快照,而多能性的不同状态之间的转换与整体转录和表观遗传重新编程有关。该研究发现 Spic 在基态 ESC 中快速诱导,并响应细胞外信号调节激酶 (ERK)的 抑制。SPIC 与增强子元件结合并稳定 NANOG 与染色质的结合,特别是在涉及胆碱/单碳代谢的基因(例如 Bhmt、Bhmt2 和 Dmgdh)上。此外, Spic在单碳代谢中起关键作用,降低SAM/SAH比率,从而影响H3R17me2a水平在基态多能性中增加。
[1]. Ducker GS, Rabinowitz JD. One-Carbon Metabolism in Health and Disease. Cell Metab. 2017 Jan 10;25(1):27-42. doi: 10.1016/j.cmet.2016.08.009. Epub 2016 Sep 15. PMID: 27641100; PMCID: PMC5353360. 爱基百客专注于提供领先表观组学服务。公司先后引入ChIP、CUT&Tag、WGBS、ATAC-seq、全转录组、10x Genomics、DNBSEQ-T7等实验平台,不断提升公司的科研服务能力。 至今合作的科研客户超2000家,涵盖国内知名科研院所、高校以及相关生物企业,科研成果曾多次在Cancer Cell、Nature Communications、J HEMATOL ONCOL、Plant Cell 等国际高水平学术期刊发表,受到了客户广泛好评,是国内成长最迅速的高通量测序科研服务企业之一。
了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |