NEWS
新闻资讯
|
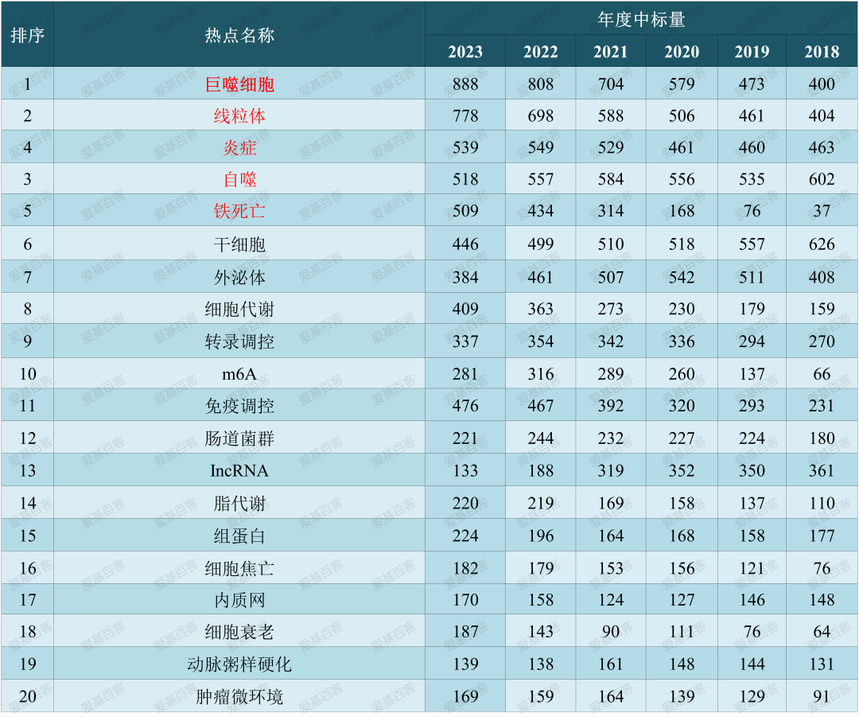
2023国自然淘金:m6A与糖酵解、铁死亡和巨噬细胞如何强强联姻?眼瞅着9月份已经过半了,2024年国自然申请工作已经可以着手准备。2018年以来巨噬细胞、铁死亡、线粒体和自噬仍旧位于国自然热点前列。而我们今天介绍的m6A,其不仅自身优秀,更可以结合巨噬细胞和铁死亡等方向进行研究。
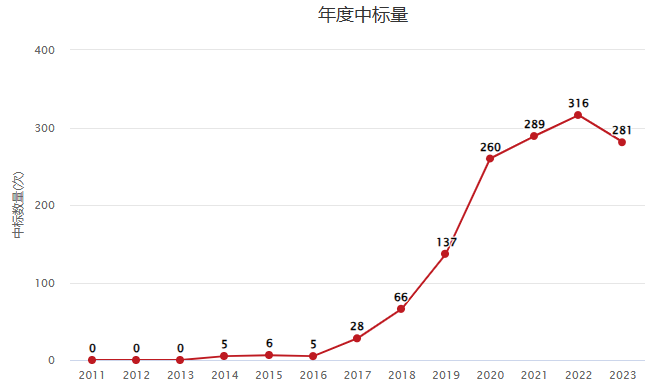
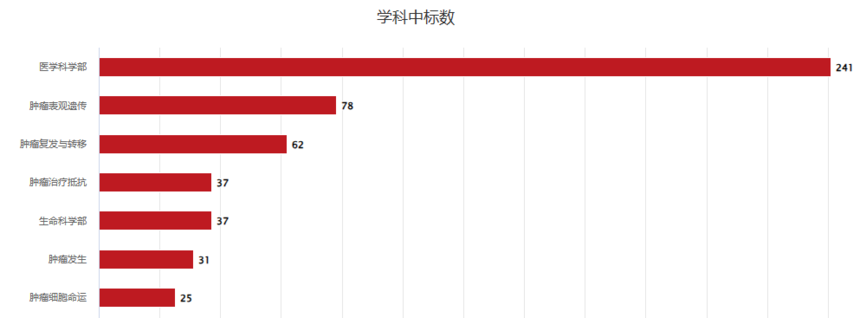
数据来源:ZCOOL 2017年至今,m6A国自然中标数量基本处于上升状态,且排行前7的学科方向主要集中于医学、肿瘤表观遗传和肿瘤复发治疗方向。Pubmed 发文数据汇总显示五年来m6A发文6043篇。除了综述外,影响因子大于10的文章约占35%。国自然和pubmed发文充分说明了m6A研究的热度。
m6A年度中标量统计(数据来源:ZCOOL)
m6A中标量学科方向统计(数据来源:ZCOOL)
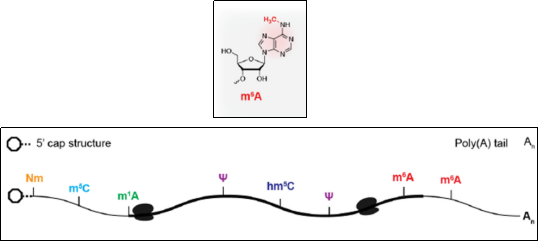
m6A文章统计(数据来源:Pubmed) m6A是哺乳动物真核细胞中普遍存在的RNA甲基化修饰。m6A修饰是在腺苷N6位上插入一个甲基基团[1],常见于RNA的3'UTR区和RRACH序列。
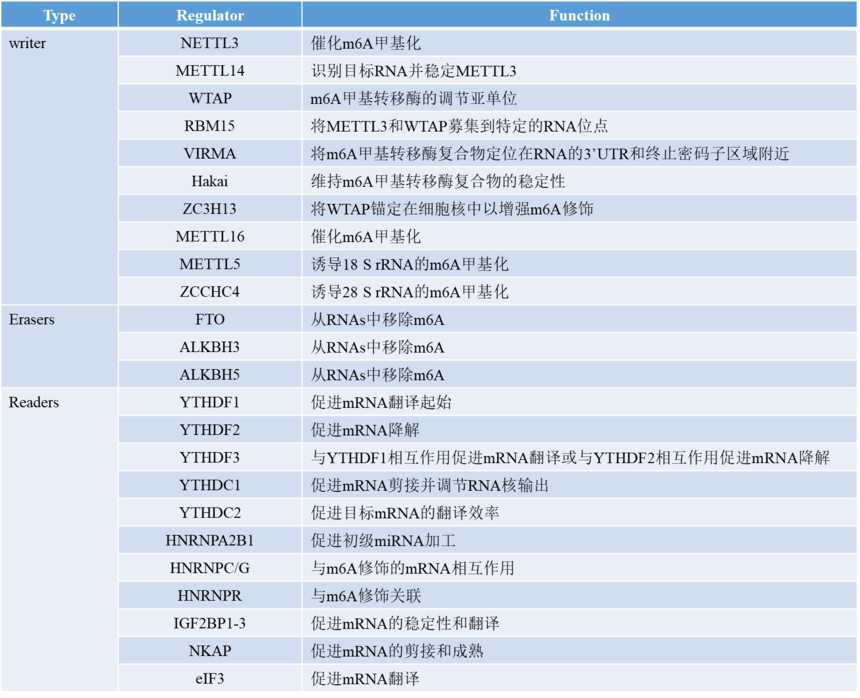
m6A甲基化过程动态可逆,这一过程由“writers”(甲基转移酶),“erasers”(去甲基酶)和“readers”(RNA甲基化识别蛋白)等共同参与。无论在动物还是植物中m6A都具有重要作用。m6A参与人类的发育、免疫、肿瘤和干细胞等多个方面。在植物中,m6A影响植物生长发育、胁迫以及作物性状改良等。m6A通过调控RNA剪接、成熟、稳定、翻译和定位等过程广泛参与基因表达,其甲基化酶在RNA代谢中的作用如下表所示: 表1:m6A甲基化酶在RNA代谢中的作用[2]
癌症的主要特征之一是代谢重编程,这涉及葡萄糖、脂肪酸、氨基酸和线粒体代谢。糖酵解位于肿瘤细胞代谢网络的核心,在肿瘤发生和发展中起着不可替代的作用。糖酵解过程为癌细胞提供能量以及生物大分子合成的底物,其产物之一的乳酸能有效抑制多种免疫细胞功能,有助于肿瘤细胞的免疫逃逸。总而言之,肿瘤糖酵解在肿瘤进展中发挥着不可或缺的作用。 而m6A修饰通过多种途径调节肿瘤糖酵解,对肿瘤的增殖、转移和治疗具有重要意义。多种肿瘤中,m6A通过直接参与糖酵解相关酶的mRNA或者通过作用于LncRNA和miRNA来调节糖酵解代谢过程,从而影响癌症进展。此外,基于相关研究 m6A和糖酵解抑制剂结合有望于助力抗肿瘤治疗。 以结直肠癌、肺癌和乳腺癌为例,甲基化相关酶作用如下[2]:
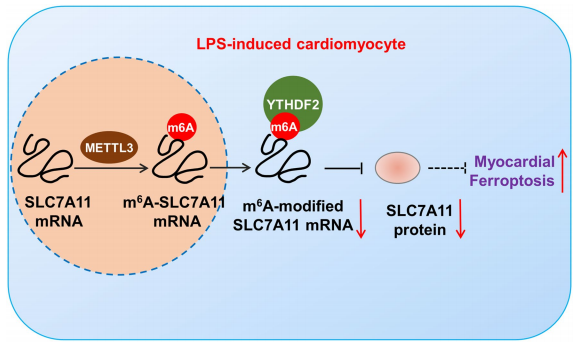
近年来,研究发现m6A与铁死亡相结合调控各种癌症。2012年提出的铁死亡(ferroptosis)是一种独特的细胞死亡方式,由铁依赖性的磷脂过氧化作用驱动。铁死亡的主要作用机制是:在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而导致细胞死亡。多种器官损伤、退行性疾病以及癌症都与铁死亡相关。多种疾病中,m6A修饰甲基化关键酶通过诱导铁死亡影响疾病进展。 脓毒症诱导的心肌损伤中,METTL3通过YTHDF2依赖的mRNA衰变过程,促进SLC7A11 mRNA的甲基化水平,接着YTHDF2加速降解,降低SLC7A11蛋白水平,诱导LSP(脂多糖)诱导的H9C2细胞铁死亡[3]。
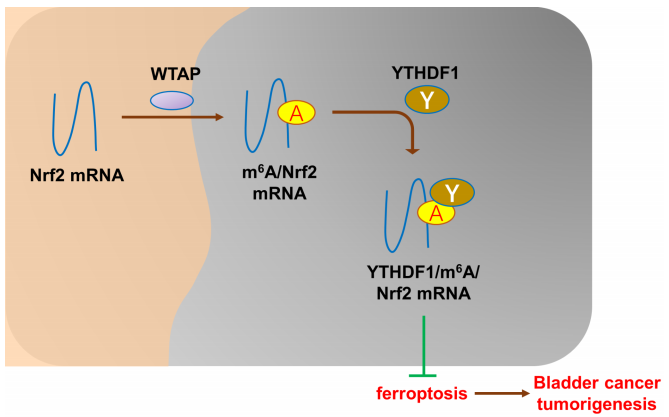
膀胱癌中m6A甲基转移酶WTAP在膀胱癌组织和细胞中上调,表明患者的预后不良。研究表明膀胱癌机制与m6A和铁死亡相关。WAP靶向NRF2通过 YTHDF1/NRF2/m6A依赖的铁死亡调节加速膀胱癌的恶性转化[4]。
巨噬细胞(macrophage)在是机体防御病原体和癌症先天免疫系统的重要组成,存在于所有组织中。它能够快速感知周围环境的信号变化,整合信号并做出相关反应从而进行机体稳态的维持。巨噬细胞基因表达精确地控制着表型形成和功能决定的过程,而这一过程受到多方面因素地调控。m6A参与基因表达的各个方面, m6A的各类甲基化酶参与巨噬细胞的发育、激活/极化、焦亡和代谢重编程[5]。基于巨噬细胞的免疫作用,m6A除了影响以上过程外,在各种疾病和癌症中,m6A介导巨噬细胞影响疾病发展和癌症进展具有重要作用。 动脉粥样硬化具有慢性炎症和动脉内层的过渡的脂肪沉淀特点,与心力衰竭、高血压和主动脉瘤在内的各种新血管疾病相关。研究表明巨噬细胞中的METTL3Z在炎症反应和动脉粥样硬化中起重要作用,METTL3通过靶向Braf mRNA调节RAS/RAF/MEK/ERK通路,YTHDF1识别被m6A修饰的Braf mRNA促进其翻译[6]。
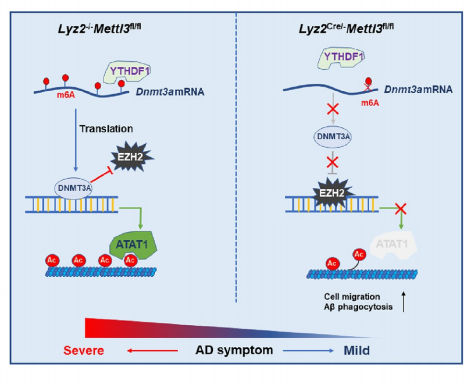
阿尔茨海默病(AD)是一种神经退行性疾病。近期研究表明单核细胞来源的巨噬细胞中METTL3缺乏改善了淀粉样-β蛋白(Aβ)诱导的AD小鼠模型的认知功能。具体机制是METTL3消融减弱了DNA甲基转移酶3A (Dnmt3a) mRNAs的m6A修饰,从而削弱YTH N6-甲基腺苷RNA结合蛋白1(YTHDF1)介导的DNMT3A(结合α-微管蛋白乙酰转移酶1(ATAT1)的启动子区域)的翻译,METTL3缺失导致ATAT1表达下调,α-微管蛋白乙酰化减少,进而促进单核细胞来源的巨噬细胞的迁移和A-β清除,缓解AD症状。因此,m6A甲基化可能是AD治疗的潜在靶点[7]。
m6A甲基化研究主要围绕着甲基化转移酶(Writers)、去甲基化酶(Erasers)和甲基化阅读蛋白(Readers)这三大组分展开相应的研究。 从m6A修饰相关调控蛋白入手,深入阐明m6A修饰生物学功能和作用机制,可以考虑如下思路:
2023年02月24日,南京医科大学刘起展团队在Cell Death & Differentiation期刊以“N6-Methyladenosine-modified circSAV1 triggers ferroptosis in COPD through recruiting YTHDF1 to facilitate the translation of IREB2”为题发表研究论文,该研究发现在慢阻肺病(COPD)肺上皮细胞中,m6A修饰的circSAV1通过募集YTHDF1,形成circSAV1/YTHDF1/IREB2的mRNA-蛋白质三元复合物,促进IREB2(铁调节蛋白) mRNA翻译,IREB2蛋白水平升高破坏铁稳态,导致不稳定铁池(LIP) 积累和脂质过氧化,从而导致铁死亡,而铁死亡引起气道重塑和肺气肿,从而导致COPD。小鼠COPD模型中,circSAV1沉默和去铁胺(DFO)治疗阻断香烟诱导的肺上皮细胞铁下垂,减弱小鼠COPD进展。因此,m6A修饰的circSAV1依赖性铁死亡是COPD的治疗靶点[8]。
2023年08月14日,南京医科大学汤琪云团队在Cell & Bioscience期刊以“Down-regulated FTO and ALKBH5 co-operatively activates FOXO signaling through m6A methylation modification in HK2 mRNA mediated by IGF2BP2 to enhance glycolysis in colorectal cancer”为题发表研究论文,研究表明结直肠癌(CRC)中, FTO和ALKBH5下调将通过IGF2BP2介导的HK2基因m6A甲基化修饰协同激活下游FOXO信号通路,促进结直肠癌糖酵解,进一步加速癌症进展[9]。
2023年08月30日,天津市人民医院高明教授团队于在Cell Death & Differentiation期刊以“METTL3 inhibition induced by M2 macrophage-derived extracellular vesicles drives anti-PD-1 therapy resistance via M6A-CD70-mediated immune suppression in thyroid cancer”为题发表研究论文,研究表明晚期乳头状甲状腺癌和间变性甲状腺癌中,M2巨噬细胞通过分泌含有miR-21-5p的胞外小泡(EV)下调肿瘤细胞中METTL3的表达,导致CD70 mRNA以YTHDF2依赖的方式去甲基化和稳定。随后CD70蛋白水平的上调增加了免疫抑制Tregs和终末耗尽的T细胞丰度,从而诱导对抗PD-1治疗的抵抗[10]。
m6A通过调控RNA剪接、成熟、稳定、翻译、定位等过程广泛参与基因表达。探索m6A过程相关酶组分功能对生物发展至关重要。在不同疾病和癌症中,m6A结合糖酵解、铁死亡和巨噬细胞的研究,对于未来的治疗至关重要。 目前,研究m6A可以采用MeRIP-seq,该技术通过特异识别m6A修饰的抗体,对细胞内具有m6A修饰的RNA片段进行免疫共沉淀。结合高通量测序和生物信息学分析,可在全基因组范围内对m6A修饰的状况进行系统研究。具有灵活度高、检测范围广、精确度高和适合大部分物种的优点。 爱基百客专注于表观遗传服务,提供MeRIP-seq从方案设计-测序-分析-验证的一站式服务。有相关需求的老师欢迎联系我们,欢迎与我们沟通。
[1]Shen H,Xie K,Tian Y, et al. N6-methyladenosine writer METTL3 accelerates the sepsis-induced myocardial injury by regulating m6A-dependent ferroptosis. Apoptosis. 2023;28 (3-4):514-524. doi:10.1007/s10495-022-01808-y [2] Yue SW,Liu HL,Su HF, et al. m6A-regulated tumor glycolysis: new advances in epigenetics and metabolism. Mol Cancer. 2023;22 (1):137. doi:10.1186/s12943-023-01841-8 [3] Shen H,Xie K,Tian Y, et al. N6-methyladenosine writer METTL3 accelerates the sepsis-induced myocardial injury by regulating m6A-dependent ferroptosis. Apoptosis. 2023;28 (3-4):514-524. doi:10.1007/s10495-022-01808-y [4] Wang K,Wang G,Li G, et al. m6A writer WTAP targets NRF2 to accelerate bladder cancer malignancy via m6A-dependent ferroptosis regulation. Apoptosis. 2023;28 (3-4):627-638. doi:10.1007/s10495-023-01817-5 [5] Zhu X,Tang H,Yang M, et al. N6-methyladenosine in macrophage function: a novel target for metabolic diseases. Trends Endocrinol Metab. 2023;34 (2):66-84. doi:10.1016/j.tem.2022.12.006 [6] Li Q,Yu L,Gao A, et al. METTL3 (Methyltransferase Like 3)-Dependent N6-Methyladenosine Modification on Braf mRNA Promotes Macrophage Inflammatory Response and Atherosclerosis in Mice. Arterioscler Thromb Vasc Biol. 2023;43 (5):755-773. doi:10.1161/ATVBAHA.122.318451 [7] Yin H,Ju Z,Zheng M, et al. Loss of the m6A methyltransferase METTL3 in monocyte-derived macrophages ameliorates Alzheimer's disease pathology in mice. PLoS Biol. 2023;21 (3):e3002017. doi:10.1371/journal.pbio.3002017 [8] Xia H,Wu Y,Zhao J, et al. N6-Methyladenosine-modified circSAV1 triggers ferroptosis in COPD through recruiting YTHDF1 to facilitate the translation of IREB2. Cell Death Differ. 2023;30 (5):1293-1304. doi:10.1038/s41418-023-01138-9 [9] Ye M,Chen J,Lu F, et al. Down-regulated FTO and ALKBH5 co-operatively activates FOXO signaling through m6A methylation modification in HK2 mRNA mediated by IGF2BP2 to enhance glycolysis in colorectal cancer. Cell Biosci. 2023;13 (1):148. doi:10.1186/s13578-023-01100-9 [10] Ning J,Hou X,Hao J, et al. METTL3 inhibition induced by M2 macrophage-derived extracellular vesicles drives anti-PD-1 therapy resistance via M6A-CD70-mediated immune suppression in thyroid cancer. Cell Death Differ. 2023;:. doi:10.1038/s41418-023-01217-x 了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |