NEWS
新闻资讯
|
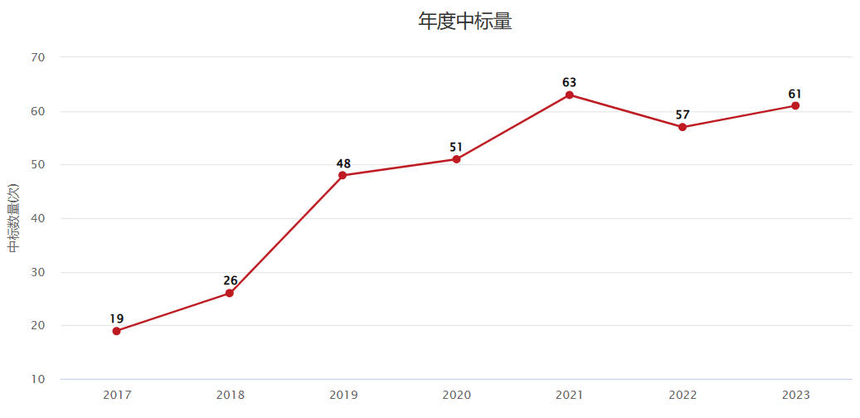
国自然热点 | “增强子”的重要标记——H3K4me1增强子是近几年的国自然新热点,2023年国自然项目最新数据显示“增强子”相关项目数稳步增长,中标61个项目。此前,我们分享过“H3K4me3”组蛋白修饰,今天聊聊增强子的标记H3K4me1修饰。
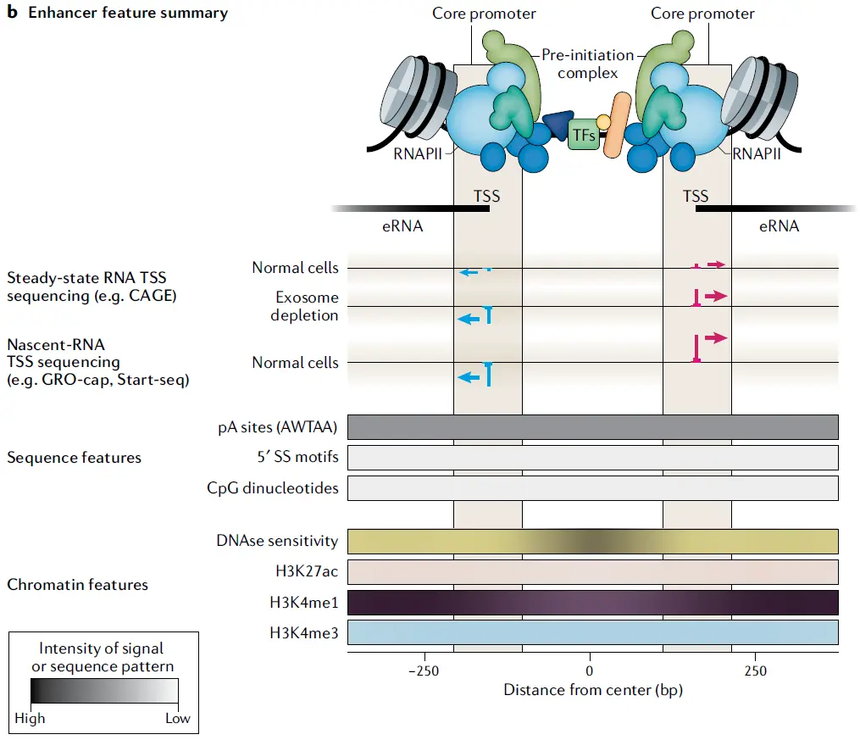
数据来源zcool 增强子是一种重要的顺式转录元件,活化的增强子染色质开放度高,结合了很多转录因子、转录共激活因子和RNA Pol II,会激活靶基因的表达。通过对多个物种和大量组织的研究发现,增强子的染色质上经常出现H3K4me1。其中,活性增强子上常有H3K4me1和H3K27ac的共定位,超级增强子上具有高密度H3K27ac和H3K4me1修饰;而只有H3K4me1,没有H3K27ac(有些有H3K27me3)的增强子则是沉默态或poised/primed增强子。增强子活性的变化经常伴随着这些组蛋白修饰的变化,其在细胞分化、细胞癌变等细胞命运变化的过程中发挥调控作用。 H3K4me1可作为增强子的标志,H3K4me3作为启动子标志。研究表明,H3K4me3主要富集在转录起始位点附近的启动子区域,而大多数H3K4me1修饰富集在增强子区域。识别H3K4me1富集区和H3K4me3贫乏区,或者H3K4me1和H3K27ac富集区,已被证明是发现增强子的可行方法。
增强子特征(图片来源PMID: 31605096) 一、 H3K4单甲基化依赖于MLL3/4的募集 基于H3K4me1标记调控的机制研究主要集中在MLL3和MLL4的作用上,这两种酶负责将未甲基化的赖氨酸4单甲基化,主要作用于增强子区域[1,2]。 之前的研究发现,MLL3(又叫KMT2C,HALR)和MLL4(又叫MLL2,KMT2D,ALR)结合在增强子上,催化H3K4me1[1-3],并招募转录共激活因子p300催化产生组蛋白乙酰化,激活增强子[3-4]。MLL3/4缺失会下调增强子活性。基于此,人们普遍认为H3K4me1可调控增强子及其靶基因的活性。 二、 H3K4me1的功能研究 1. H3K4me1与细胞分化 在间充质干细胞(MSCs)的成骨分化过程中,组蛋白去甲基化酶LSD1介导的表观遗传机制发挥重要作用。自然状态的人脂肪来源干细胞(hASC)中,LSD1在骨钙素(OC)和成骨相关转录因子抗体(OSX)启动子上高度富集,而经成骨诱导后,其富集程度明显降低,同时伴随ALP、OC、OSX、RUNX2等成骨基因表达的显著上调及组蛋白H3赖氨酸4的单甲基化和二甲基化(H3K4me1/2)水平的升高,提示LSD1通过在成骨相关基因的调控区域消除H3K4me1/2标记而抑制MSCs的成骨分化[5]。 2. H3K4me1在基因抑制中的作用 Cheng等将启动子定义为所有转录起始点(TSS)上游和下游3kb的区域,并根据H3K4me1和H3K4me3的丰富将它们分成不同的组[6]。第1组启动子同时与H3K4me1和H3K4me3相关,几乎代表了所有表达基因。第2组启动子缺乏H3K4me1,要么仅有H3K27me3标记,要么缺乏之前研究过的所有激活和抑制性组蛋白修饰,并且普遍受到抑制。组3启动子表现出独特的H3K4单甲基化模式,其中该标记跨越并延伸到整个6kb启动子区域之外。他们发现当这些第3组基因在肌发生期间被激活时,观察到TSS-近端区域的H3K4me1水平急剧下降,相比之下,在肌母细胞和肌管中组成性低水平表达的基因在启动子区域中表现出持续高水平的H3K4me1(和低水平的H3K4me3)。因此,他们得出结论,在骨骼肌、胚胎成纤维细胞和巨噬细胞中,H3K4me1与环境依赖性基因抑制有关,而基因激活与H3K4me1的缺失相关。 3. H3K4me1与细胞衰老 在分化的细胞中,衰老与富含抑制性组蛋白翻译后修饰的DNA区域的高甲基化有关。然而,与成体干细胞在生命过程中DNA甲基化变化相关的染色质标记在很大程度上仍然未知。有研究发现衰老过程中DNA低甲基化优先发生在富含H3K4me1的位置[7]。在干细胞和分化细胞中,低甲基化的CpG位点强烈富含活性染色质标记H3K4me1,这表明这是衰老过程中DNA低甲基化的一个细胞类型无关的染色质特征。 4. H3K4me1与植入前胚胎的发育 组蛋白修饰H3K4me1被广泛认为是增强子标记,该修饰如何调控卵母细胞及早期胚胎各阶段的发育尚不清楚。胡[8]等人通过免疫荧光方法证实了组蛋白修饰H3K4me1广泛存在于小鼠卵母细胞及植入前各阶段胚胎中,并描绘了卵母细胞及胚胎细胞中组蛋白修饰在H3K4me1全基因的分布图谱,发现组蛋白修饰H3K4me1主要以非经典形式存在于基因远端区域,并且其重编程发生在4细胞阶段,而非合子基因组激活的2细胞阶段。因此,该研究中对于组蛋白修饰H3K4me1的重编程规律解析揭示了并非所有的表观遗传调控均发生在合子基因组激活阶段,为我们认识表观遗传修饰在植入前胚胎发育过程中的分布模式提供一种新的视角。 5. H3K4me1与肿瘤 MCL在临床上被认为是兼有惰性和侵袭性的恶性淋巴瘤,大多数患者无法治愈,探索新的有效的治疗途径特别是寻找新型治疗靶点具有重要的临床意义。研究表明,LSD1在多种肿瘤组织中高表达,与肿瘤预后呈负相关,抑制LSD1能抑制肿瘤细胞增殖[9]。而邹[10]等采用免疫组化法检测了MCL中LSD1蛋白、组蛋白H3K4me1、H3K4me2的表达,并分析三者之间表达的相关性以及与临床病理参数的相互关系,研究结果发现MCL中LSD1蛋白呈高表达,组蛋白H3K4me1和H3K4me2呈低表达。LSD1调控组蛋白H3K4甲基化水平,可能在MCL发生、发展过程中起一定的作用,为MCL的治疗提供新思路。 H3K4me1最初被认为是一个增强子标记,尽管有越来越多的证据表明它在基因启动子中的作用。研究发现,在人类胚胎干细胞(hESCs)和正常前列腺上皮细胞(PrECs)中,启动子CpG岛和低甲基化区域(UMR)边界上H3K4me1的不同模式是区分癌症相关CpG岛超甲基化模式的关键决定因素。 三、 应用案例
2023年03月29日,中山大学深圳校区李昕/蒋璇团队在Cell & Bioscience期刊以“H3K27me3-H3K4me1 transition at bivalent promoters instructs lineage specification in development”为题发表研究论文,该研究联合干湿实验,确定了大部分二价启动子实际上是三价启动子;而这些二价启动子,也就是三价启动子,在发育过程中经历着H3K27me3-H3K4me1转换,通过不同程度的H3K4me1的累积来调控相应组织特异性基因的表达,进而调控组织发育和细胞分化。该研究赋予了H3K4me1一个新的角色,为从表观遗传学角度揭露胚胎早期发育的分子机制提供了重要线索。
二价基因的启动子由H3K4me3和H3K27me3标记,在发育和肿瘤发生中起着关键作用。H3K4me1通常与增强子有关,但H3K4me1在启动子区域也以活性双峰或抑制单峰模式存在。H3K4me1和启动子上的二价标记是否在发育中起调节作用在很大程度上尚不清楚。作者报道了在谱系分化过程中,二价启动子经历了H3K27me3-H3K4me1的转变,H3K27me3的缺失伴随着H3K4me1的双峰型丢失或单峰型富集型。更重要的是,这种转变调节了组织特异性基因的表达,以协调发育。 此外,在小鼠胚胎干细胞(MESCs)中敲除Eed(胚胎外胚层发育)或Suz12(Zest12的抑制子),可以解释维甲酸(RA)诱导下神经外胚层分化失败的原因。最后,作者发现赖氨酸特异的脱甲基酶1(LSD1)与PRC2相互作用,并参与了MESCs中H3K27me3-H3K4me1的转变。这些结果表明,H3K27me3-H3K4me1转换通过调节组织特异性基因的表达在谱系分化中起关键作用,LSD1可能通过与PrC2相互作用来调节双价启动子中的H3K4me1模式。
2023年05月04日,中山大学深圳校区李昕/蒋璇团队在BMC Genomics期刊以“Pan-cancer analysis revealed H3K4me1 at bivalent promoters premarks DNA hypermethylation during tumor development and identified the regulatory role of DNA methylation in relation to histone modifications”为题发表研究论文,该研究详细地研究了DNA高甲基化和H3K4me1之间的相互作用,强调了在癌症发展过程中一个以前未被认识的表观遗传学事件,即H3K4me1和DNA甲基化之间的相互调节。这项研究揭示了癌症表观遗传景观改变的新机制,为癌症治疗提供了新的见解。
启动子CpG岛(CGIs) DNA超甲基化是癌症的一个标志,可能导致癌症发展过程中基因表达失调,然而其动力学和调控机制尚不清楚。指导干细胞发育和分化的二价基因被发现是癌症中高甲基化的常见靶标。在这里,作者对多种癌症类型进行了综合分析,发现H3K4me1水平的下降与肿瘤发生过程中二价启动子CGIs的DNA高甲基化一致。DNA高甲基化的去除导致启动子CGIs上H3K4me1的增加,并优先于二价基因。然而,通过过表达或敲除H3K4的去甲基化酶LSD1来改变H3K4me1并不会改变DNA甲基化的水平或模式。此外,LSD1被发现调节二价基因OVOL2的表达,促进肿瘤发生。LSD1基因敲除的HCT116细胞中OVOL2基因的敲除恢复了癌细胞的表型。综上所述,该研究确定了一个可以预先标记癌细胞中DNA高甲基化的通用指标,并详细剖析了H3K4me1和DNA高甲基化之间的相互作用。目前的研究还揭示了LSD1致癌作用的新机制,为癌症治疗提供了线索。
2023年06月07日,温州医科大学第一附属医院肝胆外科徐博团队在Cancer Biology & Therapy期刊以“CSTF2T facilitates pancreatic adenocarcinoma growth and metastasis by elevating H3K4Me1 methylation of CALB2 via ASH2L”为题发表研究论文,该工作揭示了CSTF2T作为RNA结合蛋白(RBP)与ASH2L结合,通过上调H3K4me1甲基化,使CALB2水平升高,从而促进胰腺癌(PAAD)的生长和转移。
胰腺癌(PAAD)是世界范围内与癌症相关的主要死亡原因。该文就CSTF2T/ASH2L/CALB2轴在PAAD进展中的作用做一综述。用RT-qPCR和Western印迹法检测PAAD组织和细胞中CALB2的表达。在PAAD细胞中进行获得和丧失功能的实验后,使用流式细胞仪、Transwell、CCK-8和Scratch检测细胞的凋亡、侵袭、增殖和迁移。此外,用免疫印迹法检测细胞增殖标记物、细胞凋亡、转移和侵袭相关蛋白的表达。 通过ChIP、RNA pull-down、RIP和Co-IP分析评价CALB2、KMT2D、ASH2 L、H3K4me1和CSTF2T之间的关系。建立裸鼠移植瘤模型,观察肿瘤生长和转移情况。CALB2在PAAD组织和细胞中高表达。在机制上,KMT2D富含CALB2启动子,CSTF2T作为RNA结合蛋白与ASH2结合并上调,这是KMT2D复合体的核心成分,通过上调H3K4me1来增强CALB2的表达。CALB2基因敲除可降低PAAD细胞的存活率、侵袭力和迁移能力,但增加细胞的凋亡率。同样,CSTF2T基因敲除抑制了PAAD细胞的生长和转移,并抑制了裸鼠移植瘤的生长和转移,这一作用可被进一步过表达的CALB2所抵消。CSTF2T基因敲除阻断了ASH2L/CALB2轴,以防止PAAD的生长和转移。 综上所述,H3K4me1修饰作为一种重要的染色质标记,在基因表达调控和细胞发育中发挥重要作用,对H3K4me1的深入研究有助于我们更好地理解基因调控网络的复杂性和染色质修饰在疾病中的作用,为相关疾病的治疗和预防提供新的策略和方向。未来的研究应进一步探究H3K4me1与其他修饰之间的相互作用,以及其在不同细胞类型和疾病进展中的动态变化。 近年来,发展了多种新技术和方法用于研究H3K4me1修饰,包括ChIP-seq、CUT&Tag以及单细胞ChIP-seq等。这些技术的发展使我们对H3K4me1在基因调控和疾病发生中的作用有了更深入的了解。 爱基百客专注于表观遗传服务,具有丰富的ChIP-seq、CUT&Tag以及单细胞测序等项目经验,能够为您提供优质的技术服务。新产品单细胞ChIP-seq上新福利多多,如果您有这方面的技术需求,欢迎与我们沟通呀~
[1]Herz, H. M., Mohan, M., Garruss, A. S., Liang, K., Takahashi, Y. H., Mickey, K., Voets, O., Verrijzer, C. P., & Shilatifard, A. (2012). Enhancer-associated H3K4 monomethylation by Trithorax-related, the Drosophila homolog of mammalian Mll3/Mll4. Genes & development, 26(23), 2604–2620. [2]Hu, D., Gao, X., Morgan, M. A., Herz, H. M., Smith, E. R., & Shilatifard, A. (2013). The MLL3/MLL4 branches of the COMPASS family function as major histone H3K4 monomethylases at enhancers. Molecular and cellular biology, 33(23), 4745–4754. [3]Lee, J. E., Wang, C., Xu, S., Cho, Y. W., Wang, L., Feng, X., Baldridge, A., Sartorelli, V., Zhuang, L., Peng, W., & Ge, K. (2013). H3K4 mono- and di-methyltransferase MLL4 is required for enhancer activation during cell differentiation. eLife, 2, e01503. [4]Wang, C., Lee, J. E., Lai, B., Macfarlan, T. S., Xu, S., Zhuang, L., Liu, C., Peng, W., & Ge, K. (2016). Enhancer priming by H3K4 methyltransferase MLL4 controls cell fate transition. Proceedings of the National Academy of Sciences of the United States of America, 113(42), 11871–11876. [5]Ge, W., Liu, Y., Chen, T., Zhang, X., Lv, L., Jin, C., Jiang, Y., Shi, L., & Zhou, Y. (2014). The epigenetic promotion of osteogenic differentiation of human adipose-derived stem cells by the genetic and chemical blockade of histone demethylase LSD1. Biomaterials, 35(23), 6015–6025. [6]Cheng, J., Blum, R., Bowman, C., Hu, D., Shilatifard, A., Shen, S., & Dynlacht, B. D. (2014). A role for H3K4 monomethylation in gene repression and partitioning of chromatin readers. Molecular cell, 53(6), 979–992. [7]Fernández, A. F., Bayón, G. F., Urdinguio, R. G., Toraño, E. G., García, M. G., Carella, A., Petrus-Reurer, S., Ferrero, C., Martinez-Camblor, P., Cubillo, I., García-Castro, J., Delgado-Calle, J., Pérez-Campo, F. M., Riancho, J. A., Bueno, C., Menéndez, P., Mentink, A., Mareschi, K., Claire, F., Fagnani, C., … Fraga, M. F. (2015). H3K4me1 marks DNA regions hypomethylated during aging in human stem and differentiated cells. Genome research, 25(1), 27–40. [8]胡开悦. 组蛋白修饰H3K4me1在小鼠植入前胚胎的调控机制研究[D].郑州大学,2022. [9]Wang, J., Lu, F., Ren, Q., Sun, H., Xu, Z., Lan, R., Liu, Y., Ward, D., Quan, J., Ye, T., & Zhang, H. (2011). Novel histone demethylase LSD1 inhibitors selectively target cancer cells with pluripotent stem cell properties. Cancer research, 71(23), 7238–7249. [10]邹宗楷,黄轶群,沈洪武等.套细胞淋巴瘤中LSD1、H3K4me1、H3K4me2蛋白表达及临床意义[J].临床与实验病理学杂志,2015. 了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |