NEWS
新闻资讯
|
非编码RNA | LncRNA在植物中的研究进展近些年来,长链非编码RNA(lncRNA)作为科研领域备受瞩目的研究方向,与其相关的研究也一直是国自然的热点,对应的研究已在多种高水平杂志上发表。目前,lncRNA的文章数量逐步上升,研究模式也逐渐完善,因此,需要发表lncRNA的高水平文章、申请国自然就需要完整的lncRNA研究体系。
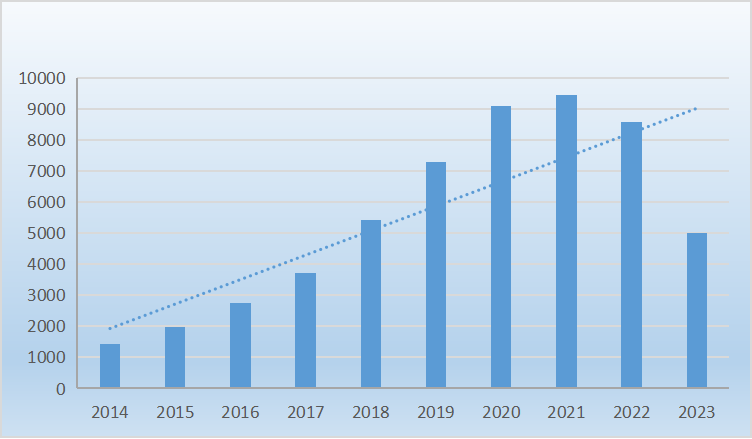
近10年lncRNA年发表文章数(数据来源PubMed,截止2023.10) 随着大量非编码基因的发现,研究人员已经从基因编码转向非编码,并在体内研究它们的作用方式。研究表明,非编码基因在哺乳动物和植物物种中发挥着重要的调控作用,影响着它们的生产、生长和应激反应,为研究提供了有价值的目标和思路。由于lncRNA在体内条件下的多功能性和多义性,对其分子机制的研究才刚刚开始。探索lncRNA在植物中的功能需要更多的努力来发现和增加它们的分子通路。
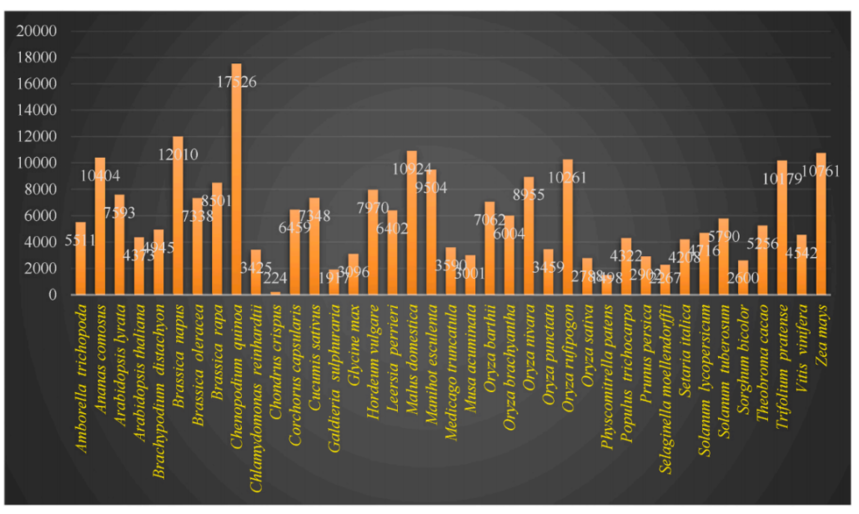
鉴定 lncRNA 总数的植物(图片来源Plant Physiology and Biochemistry 194 (2023) 96–110) 一、LncRNA的生物发生 LncRNA占全部ncRNA的80%-90%,是一类转录长度超过200nt的非编码序列,因其缺少有效开放阅读框而很少编码或不能编码蛋白质。目前研究发现,大部分lncRNA由RNA聚合酶II(pol II)或其他RNA聚合酶转录,并通过5’端加帽,3’端聚腺苷酸化(poly)形式发生与mRNA类似的剪接过程[1]。lncRNA转录也发生在基因组的多个位置,包括转录的起始和结束位点、内含子或增强子剪接区域。虽然它们中的大多数并不稳定[2]。 二、LncRNA的功能 RNA不仅仅是承担遗传信息中间载体的辅助性角色,而是更多地承担了各种调控功能。lncRNA发挥功能主要依靠其二级结构,与蛋白质结合,可引起染色质重构、影响转录因子功能等。另外,还可以在其线性水平与miRNA结合,间接影响mRNA表达,也可以直接与mRNA结合,影响mRNA翻译、剪切和降解过程。 · 转录调控:作为诱饵与转录因子结合抑制mRNA的转录; · 表观遗传调控:lncRNA可以招募染色质重构复合体介导某些基因的表达沉默;lncRNA还可以参与到维持染色体数目的稳定; · 转录后调控:海绵作用吸收microRNA;直接与mRNA结合降解或抑制mRNA的翻译;与蛋白结合激活或抑制蛋白活性。
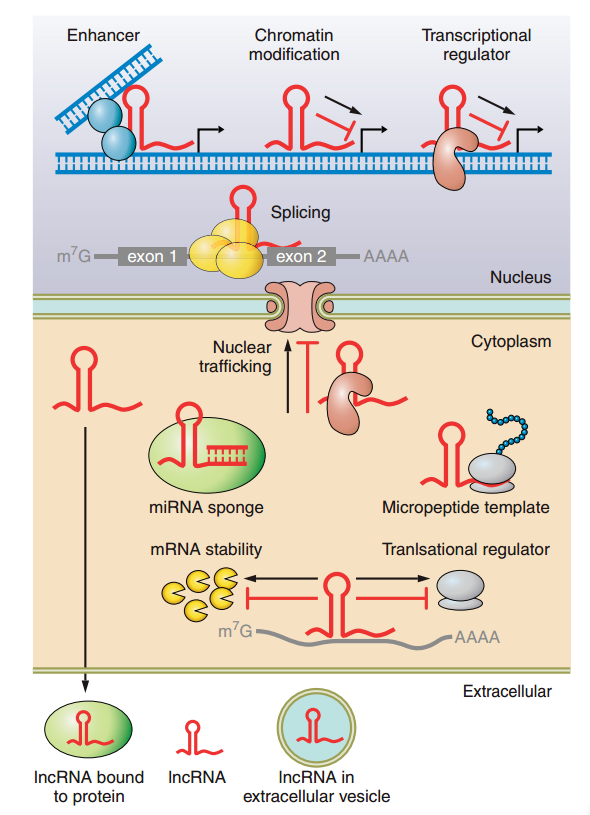
LncRNA的生物发生与功能(图片来源Physiol Rev•VOL 96•OCTOBER 2016•www.prv.org) 三、LncRNA的分类 LncRNA通常由RNA聚合酶II转录,根据其相邻蛋白编码基因组的位置,可被分为以下六类: Sense lncRNAs,正义lncRNA:转录自同一链上的蛋白质编码基因的重叠外显子; Antisense lncRNAs,反义lncRNA:转录自反义链上蛋白质编码基因的重叠外显子; Bidirectional lncRNAs,双向lncRNA:与蛋白质编码基因共享相同的启动子,但转录方向相反; Intronic lncRNAs,内含子lncRNA:主要产生于编码基因的内含子区域; Intergenic lncRNAs,基因间区的lncRNA (LincRNA):主要产生于两个编码基因的中间区域; Enhancer lncRNAs,增强子lncRNA:由蛋白质编码基因的增强子区域产生。 相对于哺乳动物,植物lncRNA研究相对落后。植物lncRNA的研究可以揭示植物生长和分化的未知新机制,lncRNA在植物开花、雄性不育、营养代谢、生物和非生物胁迫等多种生物过程中起着调节因子的作用。随着高通量测序技术的发展,越来越多的lncRNA被鉴定出来,但具体的作用与功能仍然不是很清楚,因此lncRNA的研究领域依然是一片非常广阔的神秘区,具有极大的研究价值。 四、LncRNA的生物学功能 植物进化出许多复杂的机制,作为对生物胁迫的保护,以抑制有效的疾病和减少对其他组织的伤害。随着病原性感染的发生,过敏反应在转录上引发并启动了一个复杂的信号网络。在最近的研究中,针对植物病原体,lncRNA在分子水平上进行修饰以达到防御目的的意义已经被揭示。
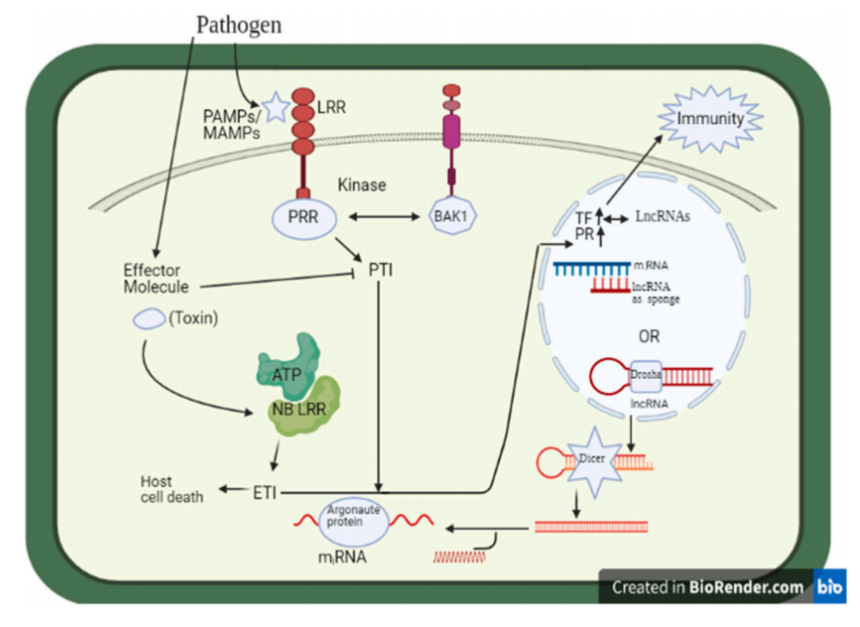
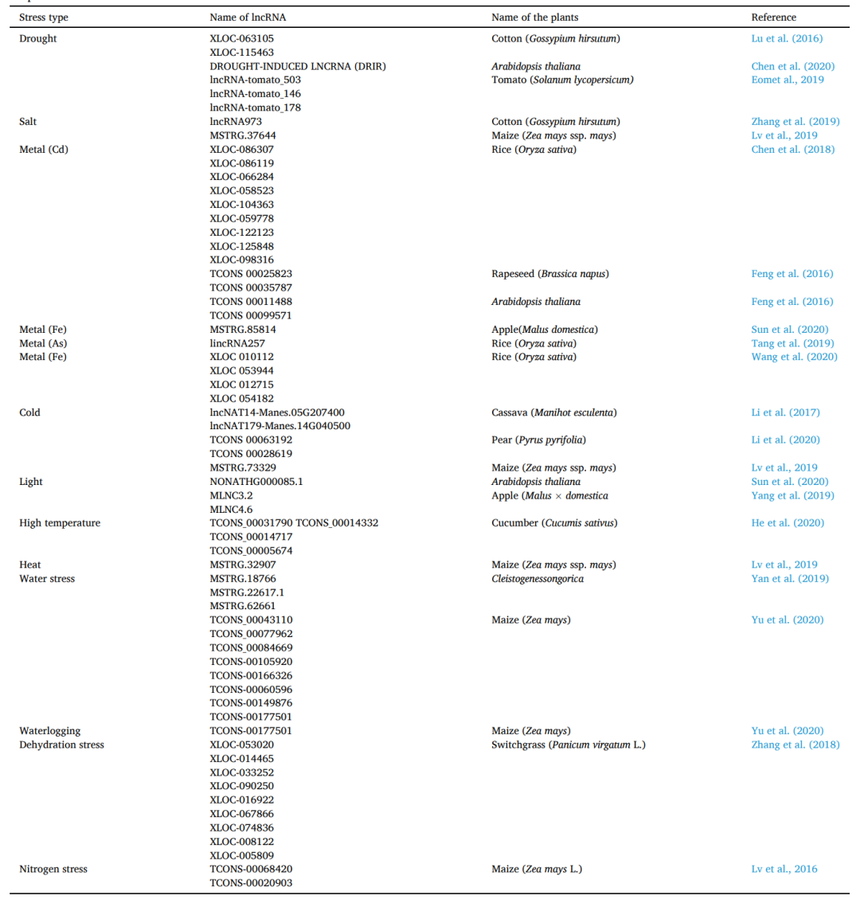
响应生物胁迫的防御机制概述(图片来源Plant Physiology and Biochemistry 194 (2023) 96–110) 1.1 LncRNA和线虫 线虫被认为是最具灾难性的土壤作物害虫。首先,线虫侵入根系统,诱导形成多核巨细胞,导致根瘤形成[3]。这种损害导致水分和养分的吸收减少,导致植物叶片黄化、叶片枯萎、产量减少和作物标准降低[4]。如今,下一代测序的应用增强了我们分析转录组学的适用性,这也可能有助于注释lncRNA的基因调控。Li等(2018)通过GO和KEGG分析揭示了lncRNA靶基因参与植物逆境条件、激素信号转导、超敏反应和细胞壁的生物发生,而细胞壁合成、逆境激素信号传导和新陈代谢相关的基因的差异表达有助于植物抵抗线虫的入侵。此外,565个差异表达的lncRNA已经被证实参与了对线虫的应激反应,这一点通过使用15个随机选择的lncRNA基因的qPCR进一步得到证实[5]。 1.2 LncRNA对细菌感染的响应 致病性的细菌感染通常涉及各种类型的植物病害。最近,一项研究让我们深入了解了茉莉酸(JA)途径与 lncRNA 之间的联系,以维持对植物病害的抵抗力。Yu等(2020)对感染水稻白叶枯病菌的水稻叶片的链特异性RNA-seq分析[6]。在不同的时间间隔内,稻瘟病菌(Xoo)识别了567个对疾病有反应的lncRNA。为了验证lncRNAs与JA相关基因之间的协同作用,研究了它们的共表达,揭示了39个JA相关基因与73个lncRNA之间的相互作用。此外,lncRNA和ALEX1在Xoo感染下被高度激活。ALEX1的过表达验证了JA途径的刺激和细菌性枯萎病抗性。因此,该研究实现了我们对JA途径与lncRNA之间关系的认识,以调节疾病抗性。 1.3 LncRNA对昆虫的响应 昆虫在六足纲中占有一席之地,是节肢动物门中数量最多的物种。它们可以通过咀嚼、吸吮或切割植物产卵来感染植物。了解基因水平上的相互作用将使我们能够设计出一种保护作物免受食草动物侵害的绝佳方法。Zhang等人(2018)对棉花四叶期叶片在不同时间间隔受到棉蚜的攻击和危害而没有被棉蚜破坏的情况下进行了RNA-seq[7]。在6个RNA-Seq中,他们报告了8414个lncRNA。据报道,1331个lncRNA存在差异表达。此外,GO和KEGG的研究发现,许多编码蛋白质的基因是lncRNA的靶标,与应激条件有关。在8414个lncRNA中,有55个lncRNA被认为是285个miRNA的靶模拟序列。所有筛选到的与蚜虫损伤相关的lncRNAs均被qPCR证实。因此,他们的研究为棉花lncRNA对棉蚜危害的反应提供了新的见解。 1.4 LncRNA对病毒感染的响应 最初,病毒感染单个细胞,劫持它们的机制,自我复制,然后传播到其他细胞。最后,病毒通过使维管系统变得脆弱而感染幼叶的根部[8]。为了扩大我们对lncRNA在植物抵御病毒感染的防御机制中的作用的认识,大量的研究正在进行中。在最近的一项分析中,通过RNA-seq发现,lncRNA 参与了中国小麦花叶病毒 (CWMV) 诱导的感染。CWMV感染烟草后,共发现1175个lncRNA,其中65个lncRNA被研究。与 GO 和 KEGG 通路富集评估一致,这些已报道的 lncRNA 参与植物激素信号转导,并且不仅仅是一种类型的富集通路[9]。 1.5 LncRNA对病原真菌的响应 真菌是真核生物群体中的具有高度多面性的一员,它已经占据了自然栖息地的大部分。大多数真菌都是真正的腐生植物。在近万种常见真菌中,只有不到10%的真菌能够侵染植物并引起病害。核盘菌(Sclerotinia sclerotiorum)是一种可导致向日葵菌核病( SHR)的坏死性真菌,是危害向日葵作物的病害之一。Fass等(2020)对1个敏感(HA89)和2个耐性(HA853和RK416)向日葵自交系(IL)进行了转录组学分析,研究了lncRNA在防御初期的重要作用。为了预测结合能力,他们使用了相同IL的蛋白质编码基因和lncRNA(这些基因在4 dpi和8 dpi时差异表达)作为输入,并确认RK416有一个可能的mRNA-lncRNA相互作用,HA89有9个,HA853没有。6对在不同时间点有差异连接,4对在8dpi时被报告。因此,这些分析展示了向日葵中lncRNA与真菌感染的关系[10]。 干旱、温度、盐度、光强变化、伤害、重金属、营养缺乏、霜冻和辐射等环境胁迫是制约农业生产的主要环境胁迫,作物的生理、形态、生化和分子水平受到广泛影响影响。植物已经形成了防御网络,以减少这些因素的不利影响。最近,发现多种lncRNA与蛋白质编码基因和miRNA结合在一起,提供非生物胁迫反应。 表1 非生物胁迫下lncRNA的响应(数据来源Plant Physiology and Biochemistry 194 (2023) 96–110)
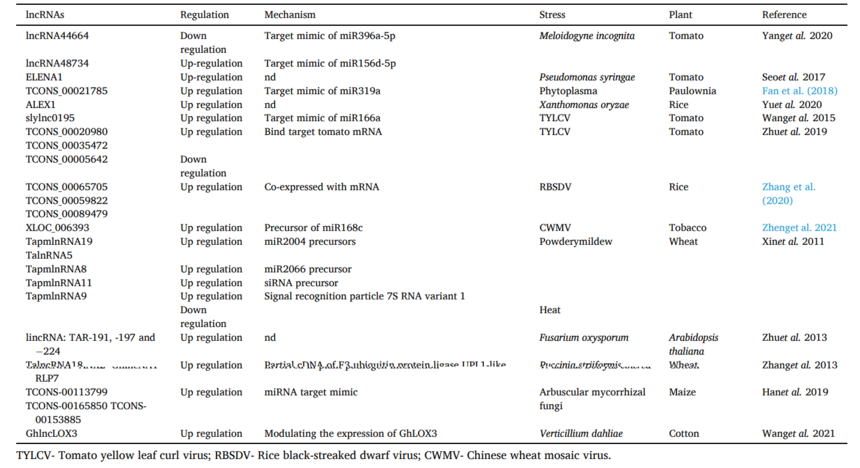
2.1 LncRNA对干旱胁迫的响应 干旱胁迫一直是影响植物生长发育的关键环境因子,随着非编码RNA研究取得进展,lncRNA独特的生物学特性和功能被鉴定,大量研究表明lncRNA与干旱胁迫反应有关。在棉花中,基于对差异表达基因的深入研究,干旱胁迫与植物激素信号转导密切相关。Lu等(2016)的分析发现总共有9、247、20和28个lncRNA分别显示对乙烯、生长素、赤霉素和细胞分裂素具有顺式作用。大约有407个lncRNA被发现与泛素相关,泛素在应激反应中可能参与信号转导和蛋白质降解。反式作用的167、3086、239、334和2621个lncRNA靶点对分别与乙烯、吲哚-3-乙酸、赤霉酸、细胞分裂素和泛素偶联,显示出干旱胁迫下植物激素的显著变化[11]。 2.2 LncRNA对盐胁迫的响应 目前,盐胁迫是限制农艺产量的最重要环境因素。在大麦[12]、苜蓿[14]和高粱[15]等多种植物中已经报道了lncRNA的功能特性。盐胁迫下lncRNA的首次报道是在拟南芥中发现的,其中35S∷npc536突变体超过了npc536的积累,与野生植物相比,根系生长增加[16]。在棉花中,lncRNA-973的过表达通过修饰盐胁迫相关基因提高了耐盐性[13]。 2.3 LncRNA对金属应力的响应 在对不同营养胁迫的响应中,lncRNA参与其中,但lncRNA在不同金属胁迫中的功能作用尚未明确。Cd胁迫下水稻根系中全基因组lncRNA的深度测序和表达模式显示,与未处理相比,Cd处理下的水稻根系中有多个lncRNA高表达。通路分析有助于确定Cd胁迫下差异表达的lncRNA的靶基因,例如已报道的类胡萝卜素生物合成通路(xloc-086119和xloc-066284)、半胱氨酸和蛋氨酸代谢通路(xloc-086307)、脱落酸信号转导通路、次生代谢物(xloc-104363、xloc-058523和xloc-059778)和光合作用(xloc-125848、xloc-122123和xloc-098316)[17]。 2.4 LncRNA对冷胁迫的响应 芽休眠是植物冬季重要而复杂的保护机制,lncRNA 在休眠过程中的作用在很大程度上仍不清楚。Li等通过模拟四种不同的冷积累条件来诱导梨花芽进入不同的休眠状态,然后,进行了RNA-seq 分析,检测到了7594个lncRNA并对其进行了特征分析[18]。作者研究了蛋白质编码基因和lncRNA之间的关联。大多数lncRNA-mRNA对被发现与催化活性、细胞活性和代谢活性相关。在应对冷胁迫时,模式分析预测了204个冷响应lncRNA及其靶基因参与植物激素信号转导(XR 667909.2)和细胞周期进程(TCONS 00063192)等重要信号通路。此外,三个lncRNA-miRNA- mRNA的表达模式与它们之间的预期关系一致,lncRNA作用于miRNA的表达,进而增加了内休眠的释放,影响冷胁迫下内源ABA的表达。这可能表明这些 lncRNA 可能有助于ABA代谢途径和细胞周期在寒冷时的进展。 2.5 LncRNA对光的响应 光作为一种主要的外界信号,调控植物的生长发育。在拟南芥幼苗中,在蓝光信号和甘露醇胁迫期间,表达了一些未知功能的lncRNA,其中4197个mRNA、375个miRNA和481个lncRNA,或5207个mRNA、286个miRNA和545个lncRNA在蓝光处理2小时或8小时的研究中报告了它们的差异表达[19]。lncRNA 还可以影响花青素的生物合成,对‘红富士’品种苹果皮的RNA-seq分析表明,在光诱导的花青素快速积累过程中,有5297个可能的lncRNA。MLNC3.2和MLNC4.6是两种差异表达的lncRNA,通过miRNA-lncRNA-mRNA网络和eTM研究,它们被预测为miRNA156a的潜在内源性靶模拟物(eTM),并且在光诱导花青素生物合成过程中有利于SPL2和SPL33转录因子的表达[20]。 表2 植物中与防御反应相关的lncRNA (数据来源Plant Physiology and Biochemistry 194 (2023) 96–110)
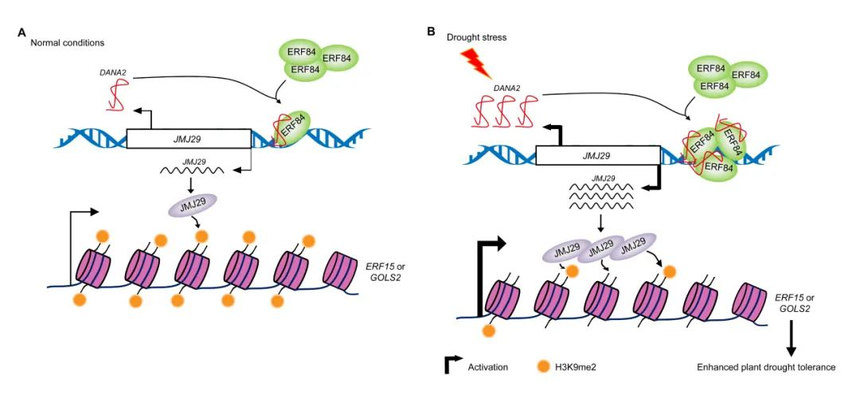
3.1 调控开花时间 植物能够繁殖成功与花过渡的合适时间和强健的花形态发生紧密相连。植物的开花受多方面的调控,lncRNA参与植物的春化作用。在拟南芥中,开花阻遏物FLOWERING LOCUS C(FLC)是调节春化的关键基因[21]。lncRNA COLDAIR从FLC的第一个内含子转录,通过招募多梳复合物PRC2-CLF引导至FLC,抑制H3K27me3的建立,同时在FLC基因座诱导H3K4me3,促进FLC表达增强,从而调控拟南芥的开花。 3.2 调节生殖器官发育 开花之后,花序分生组织开始产生花分生组织,从而产生不同类型的花器官。LINC- AP2是一个与花发育调节因子APETALA2 (AP2)相近的基因间lincRNA。而在感染Turnip crinkle virus(TCV)后,AP2的表达下调,LINC-AP2的表达上调,并且LINC-AP2的强烈上调与异常的花状结构相关[22]。 3.3 调节叶片发育 叶片是植物进行光合作用的主要器官。大多数高等植物的叶片进化出扁平的形状以最大限度地提高光合能力。中国科学院遗传与发育生物学研究所朱立煌研究组鉴定到一个影响水稻叶片平展性的长链非编码RNA基因—TWISTED LEAF(TL),它是水稻lncRNA对OsMYB60的反义表达,通过调控其sense mRNA的表达来维持叶片的扁平[23]。 迄今为止,所有的植物科学研究都表明,lncRNA具有多种作用,并通过不同的机制促进基因表达以应对外界刺激。然而,对植物lncRNA的研究还处于萌芽阶段,植物lncRNA的活性还需要进一步的研究。研究人员发现,lncRNA是复杂的应激响应途径中的多维调控元件,在生物和非生物应激中以组织依赖和应激特异性的方式在细胞应激中发挥关键作用。尽管对植物lncRNA行为的解释还远远不到我们的理解,但lncRNA是否操纵效应子或反之亦然来激发免疫仍然是模糊的。事实上lncRNA的用途不仅限于作为逆境反应调节因子,它们还在植物发育调节、开花、激素调节和致病等方面发挥着重要作用。 LncRNA 还被发现作为分子标记,用于育种目的和植物病原体的早期识别,以实现生物安全技术的精确性。未来,lncRNA可能作为最有价值的分子水平杀虫剂来中和病原体的危害,并具有抗病特性,全球粮食安全有望得到改善。 五、案例分析 长链非编码RNA DANA2通过募集ERF84促进JMJ29介导的组蛋白去甲基化来正调节耐旱性 2023年8月,Molecular Plant发表了一篇题为“The long non-coding RNA DANA2 positively regulates drought tolerance by recruiting ERF84 to promote JMJ29-mediated histone demethylation”的研究论文,该研究阐明了长链非编码RNA DANA2在干旱反应中起到正向调控的作用,并与ERF84共同调节JMJ29的转录。
发表期刊:Molecular Plant 影响因子:27.5 发表时间:2023年8月7日 植物中已经发现了数以万计的lncRNA,然而,其中很少有对其生物学功能和作用方式的分子机制进行全面研究。本研究表明拟南芥lncRNA DANA2与细胞核中的AP2/ERF转录因子ERF84相互作用,然后改变JMJ29的转录,JMJ29是一种含有Jumonji C结构域的组蛋白H3K9去甲基酶。RNA-seq和遗传分析都表明,DANA2通过JMJ29正向调节干旱胁迫反应。JMJ29的表达可以通过直接相互作用和调节H3K9me2去甲基化来正向调控ERF15和GOLS2的表达。因此,JMJ29的突变抑制ERF15和GOLS2表达,导致耐旱性受损,这与dana2和erf84突变体的干旱敏感表型一致。本研究结果表明,DANA2是干旱响应的正调节因子,并且DANA2与新型转录激活因子ERF84共同调节干旱响应过程中JMJ29的表达。
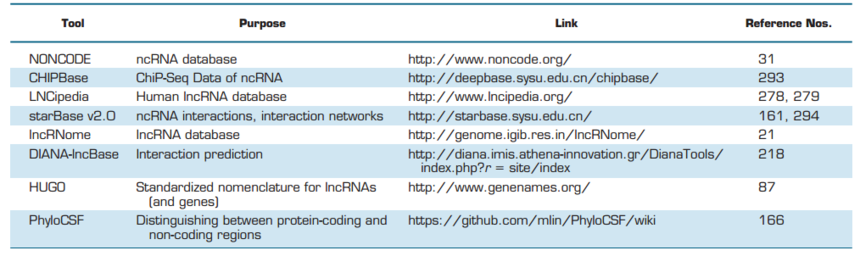
LncRNA DANA2在植物干旱响应中起作用的工作模型 原文链接:https://www.cell.com/molecular-plant/fulltext/S1674-2052(23)00217-4 六、LncRNA的研究方法 越来越深入的RNA-seq分析揭示了lncRNA在多种细胞刺激和生理病理环境中的差异表达。这样的分析可以找出最适合后续功能研究的异常表达的lncRNA。 LncRNA-seq主要利用高通量测序技术进行lncRNA测序,并结合生物信息学的预测工具进行lncRNA分析,分析lncRNA与特定生物学过程的关系。该方法可以更加高效的获取lncRNA序列及位置信息,还可对新的lncRNA进行预测及功能分析,极大促进lncRNA的深入研究。 可用于验证不同样品之间的差异基因表达。 可用于检测样品中lncRNA的位置,后者显示出更高的灵敏度和特异性。 可发现与lncRNA相关的蛋白。 表3 用于lncRNA研究的软件和数据库(数据来源Physiol Rev•VOL 96•OCTOBER 2016•www.prv.org)
生物的表型是由遗传学和表观遗传学共同决定的,表观遗传学是指在碱基序列没有改变的情况下,基因表达的过程也会受到影响,从而使细胞或生物个体的表型发生可遗传的改变。目前表观遗传学的研究内容主要有:DNA/RNA甲基化、组蛋白修饰、非编码RNA和染色质重塑等。大量研究表明这些表观机制参与植物种子萌发生长发育、开花结果、逆境胁迫和病原免疫等多个方面。 针对植物DNA甲基化、组蛋白修饰、非编码RNA、转录因子和染色质可及性等表观调控机制,爱基百客拥有丰富多样的产品解决方案。有相关需求欢迎联系我们。
市场部小助理,项目咨询
[1]Liu, J., Jung, C., Xu, J., Wang, H., Deng, S., Bernad, L., Arenas-Huertero, C., Chua, N.H., 2012. Genome-wide analysis uncovers regulation of long intergenic noncoding RNAs in Arabidopsis. Plant Cell 24 (11), 4333–4345. [2]Ntini, E., Jarvelin, ¨ A.I., Bornholdt, J., Chen, Y., Boyd, M., Jørgensen, M., Andersson, R., Hoof, I., Schein, A., Andersen, P.R., Andersen, P.K., 2013. Polyadenylation site–induced decay of upstream transcripts enforces promoter directionality. Nat. Struct. Mol. Biol. 20 (8), 923 [3]Mo, J., Wang, Y., Hu, F., Guo, T., 2011. Diagnosis and control techniques of major diseases of eggplant in Guangxi. J Chang Vegatables 18, 67–70. [4]Naz, I., Palomares-Rius, J.E., Blok, V., Khan, M.R., Ali, S., Ali, S., 2013. In vitro and in planta nematicidal activity of Fumaria parviflora (Fumariaceae) against the southern root-knot nematode Meloidogyne incognita. Plant Pathol. 62 (4), 943–952. [5]Li, X., Xing, X., Xu, S., Zhang, M., Wang, Y., Wu, H., Sun, Z., Huo, Z., Chen, F., Yang, T., 2018. Genome-wide identification and functional prediction of tobacco lncRNAs responsive to root-knot nematode stress. PLoS One 13 (11), e0204506. [6]Yu, Y., Zhou, Y.F., Feng, Y.Z., He, H., Lian, J.P., Yang, Y.W., Lei, M.Q., Zhang, Y.C., Chen, Y.Q., 2020. Transcriptional landscape of pathogen-responsive lnc RNA s in rice unveils the role of ALEX 1 in jasmonate pathway and disease resistance. PlantBiotechnol. J. 18 (3), 679–690. [7]Zhang, L., Wang, M., Li, N., Wang, H., Qiu, P., Pei, L., Xu, Z., Wang, T., Gao, E., Liu, J., Liu, S., 2018. Long noncoding RNA s involve in resistance to Verticillium dahliae, a fungal disease in cotton. PlantBiotechnol. J. 16 (6), 1172–1185. [8]Colvin, J., Omongo, C.A., Govindappa, M.R., Stevenson, P.C., Maruthi, M.N., Gibson, G., Seal, S.E., Muniyappa, V., 2006. Host-plant viral infection effects on arthropodvector population growth, development and behaviour: management and epidemiological implications. Adv. Virus Res. 67, 419–452. [9]Zheng, W., Hu, H., Lu, Q., Jin, P., Cai, L., Hu, C., Yang, J., Dai, L., Chen, J., 2021. Genome-wide identification and characterization of long noncoding RNAs involved in Chinese wheat mosaic virus infection of Nicotiana benthamiana. Biology 10 (3), 232. [10]Fass, M.I., Rivarola, M., Ehrenbolger, G.F., Maringolo, C.A., Montecchia, J.F., Quiroz, F., García-García, F., Blazquez, ´ J.D., Hopp, H.E., Heinz, R.A., Paniego, N.B., 2020. Exploring sunflower responses to Sclerotinia head rot at early stages of infection using RNA-seq analysis. Sci. Rep. 10 (1), 1–14. [11]Lu, X., Chen, X., Mu, M., Wang, J., Wang, X., Wang, D., Yin, Z., Fan, W., Wang, S., Guo, L., Ye, W., 2016. Genome-wide analysis of long noncoding RNAs and their responses to drought stress in cotton (Gossypium hirsutum L.). PLoS One 11 (6), e0156723. [12]Karlik, E., Gozukirmizi, N., 2018. Expression analysis of long non coding RNAAK370814 involved in the barley vitamin B6 salvage pathway under salinity. Mol. Biol. Rep. 45 (6), 1597–1609. [13]Zhang, J., Yang, Z., Feng, P., Zhong, X., Ma, Q., Su, Q., Wang, X., Li, C., Yang, Y., 2019. Identification and the potential roles of long non-coding RNAs in cotton leaves damaged by Aphis gossypii. Plant Growth Regul. 88 (3), 215–225. [14]Wang, T.Z., Liu, M., Zhao, M.G., Chen, R., Zhang, W.H., 2015. Identification and characterization of long non-coding RNAs involved in osmotic and salt stress in Medicago truncatula using genome-wide high-throughput sequencing. BMC Plant Biol. 15 (1), 1–13. [15]Sun, X., Zheng, H., Li, J., Liu, L., Zhang, X., Sui, N., 2020. Comparative transcriptome analysis reveals new lncRNAs responding to salt stress in sweet sorghum. Front. Bioeng. Biotechnol. 8, 331. [16]Amor, B.B., Wirth, S., Merchan, F., Laporte, P., d’Aubenton-Carafa, Y., Hirsch, J., Maizel, A., Mallory, A., Lucas, A., Deragon, J.M., Vaucheret, H., 2009. Novel long non-protein coding RNAs involved in Arabidopsis differentiation and stress responses. Genome Res. 19 (1), 57–69. [17]Chen, L., Shi, S., Jiang, N., Khanzada, H., Wassan, G.M., Zhu, C., Peng, X., Xu, J., Chen, Y., Yu, Q., He, X., 2018. Genome-wide analysis of long non-coding RNAs affecting roots development at an early stage in the rice response to cadmium stress. BMC Genom. 19 (1), 1–10. [18]Li, L., Liu, J., Liang, Q., Zhang, Y., Kang, K., Wang, W., Feng, Y., Wu, S., Yang, C., Li, Y., 2020. Genome-wide analysis of long noncoding RNAs affecting floral bud dormancy in pears in response to cold stress. Tree Physiol. [19]Sun, Z., Huang, K., Han, Z., Wang, P., Fang, Y., 2020. Genome-wide identification of Arabidopsis long noncoding RNAs in response to the blue light. Sci. Rep. 10 (1), 1–10. [20]Yang, T., Ma, H., Zhang, J., Wu, T., Song, T., Tian, J., Yao, Y., 2019. Systematic identification of long noncoding RNA s expressed during light-induced anthocyanin accumulation in apple fruit. Plant J. 100 (3), 572–590. [21]Jampala, P., Garhewal, A., Lodha, M., 2021. Functions of long non-coding RNA in Arabidopsis thaliana. Plant Signal. Behav. 16 (9), 1925440. [22]Gao, R., Liu, P., Irwanto, N., Loh, R., & Wong, S. M. (2016). Upregulation of LINC-AP2 is negatively correlated with AP2 gene expression with Turnip crinkle virus infection in Arabidopsis thaliana. Plant cell reports, 35(11), 2257–2267. [23]Liu, X., Li, D., Zhang, D., Yin, D., Zhao, Y., Ji, C., Zhao, X., Li, X., He, Q., Chen, R., Hu, S., & Zhu, L. (2018). A novel antisense long noncoding RNA, TWISTED LEAF, maintains leaf blade flattening by regulating its associated sense R2R3-MYB gene in rice. The New phytologist, 218(2), 774–788. |