NEWS
新闻资讯
|
项目文章 | Plant Physiology 华南农业大学揭示组蛋白修饰调节水稻器官大小的表观遗传机制
发表单位:华南农业大学生命科学学院 发表日期:2023年10月24日 期刊:Plant Physiology 影响因子:7.4 2023年10月24日,华南农业大学生命科学学院郑少燕副教授/刘振兰教授团队在Plant Physiology上发表题为“SET DOMAIN GROUP 711-mediated H3K27me3 methylation of cytokinin metabolism genes regulates organ size in rice”的研究论文。研究揭示了组蛋白甲基转移酶OsSDG711调节水稻器官大小的表观遗传机制,即OsSDG711通过介导H3K27me3水平调节细胞分裂素代谢途径和器官发育基因的表达。爱基百客为该研究提供了ChIP-seq的技术支持。
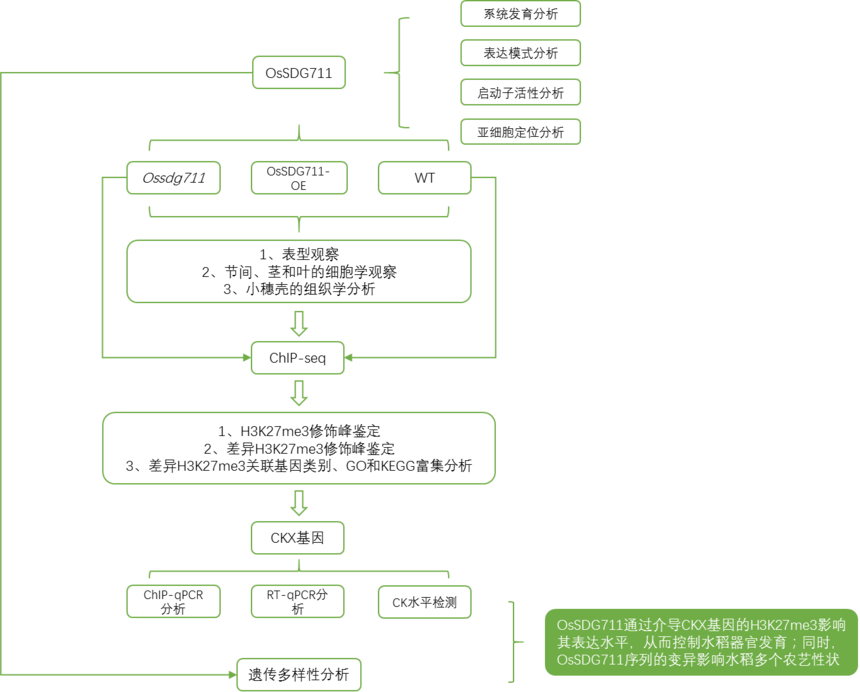
研究背景 植物器官大小有助于水稻(Oryza sativa L .)的生长和发育,影响重要的产量性状,如种子大小、叶片大小、株高和茎粗。植物激素如细胞分裂素(CKs)在这一过程中起着重要作用,其生物合成和降解是涉及多个基因调控的一系列复杂反应。CKs主要由异戊烯基转移酶(IPTs)和细胞分裂素核糖核苷5’-单磷酸水解酶(也称为LONELY GUY [LOG])生物合成,而CK分解代谢主要由细胞分裂素氧化酶/脱氢酶(CKXs)进行。组蛋白H3K27me3是一种常见的抑制基因表达的表观遗传标记,一项研究表明SDG711和JMJ703(组蛋白H3K4me3的去甲基化酶)可以结合在OsCKX2基因座上通过促进H3K27me3并抑制H3K4me3的沉积抑制OsCKX2的表达而影响小穗的发育。OsSDG711s调节H3K27me3水平如何影响水稻器官大小,以及这一过程是否涉及CKs代谢途径还不清楚。 研究思路
研究结果 1、OsSDG711通过介导组蛋白修饰调节水稻器官大小 OsSDG711是两个水稻E(z)同源物之一,研究首先对水稻和其他物种的E(z)同源物进行了系统发育分析,发现OsSDG711属于PRC2家族,与高粱EZ1变体X1蛋白具有高度同源性(77.8%),与水稻另一个E(z)同源物OsSET1具有中等同源性(51.2%)。OsSDG711包含SET和CXC结构域,表明其可能参与组蛋白修饰。在粳稻品种中花11号(ZH11)中表达OsSDG711pro:GUS报告基因,利用RT-qPCR检测不同组织中的OsSDG711表达,同时进行GUS活性检测。结果显示,OsSDG711在分生组织中表达水平较低,在幼根、茎、成熟叶和发育中的种子等生长组织中表达水平较高(图1A),且茎和节间的GUS染色较强(图1B-G)。以ZH11制备的叶鞘原生质体并导入35S:OsSDG711-GFP载体,随后进行亚细胞定位分析,在细胞核中观察到GFP信号,且与融合了细胞核定位信号(NLS)的核标记mCherry共定位(图1H、I)。这些结果表明OsSDG711主要在生长组织中表达,其编码的蛋白质主要定位于细胞核。
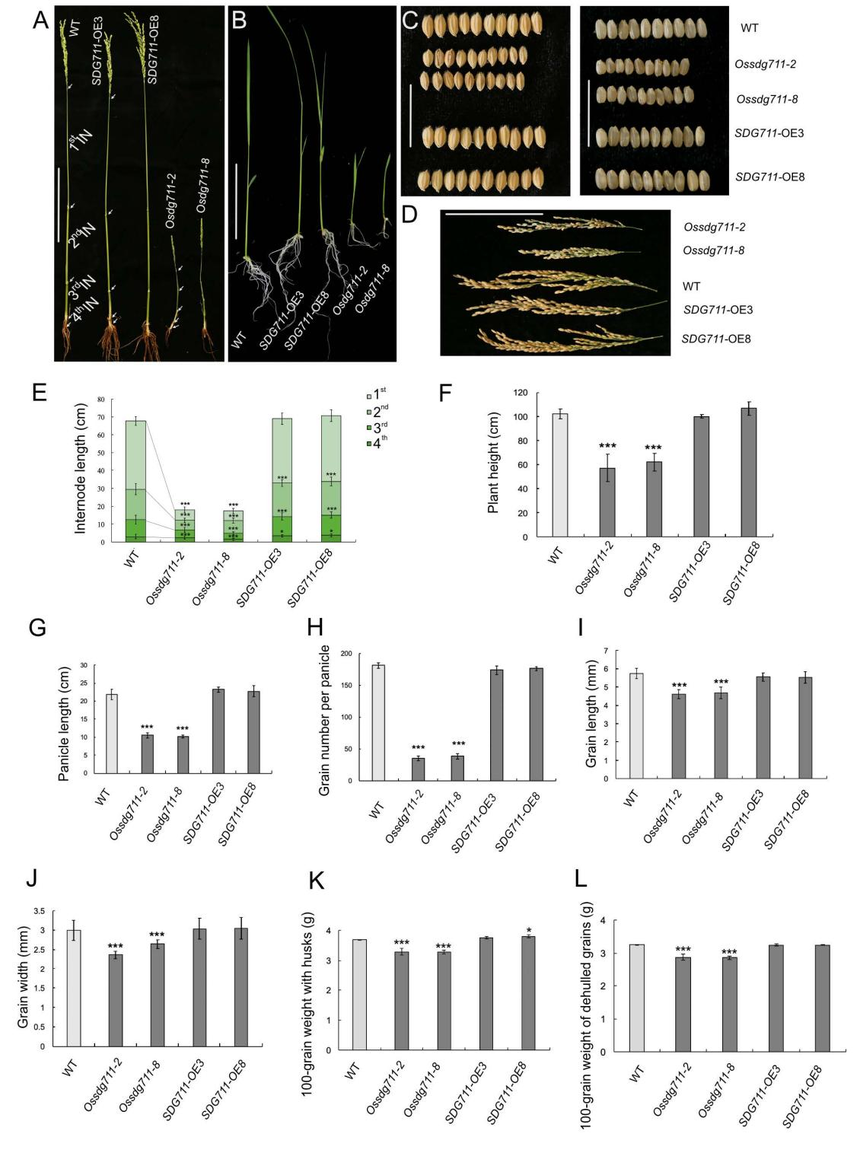
图1. OsSDG711组成型表达并编码细胞核定位的多梳蛋白 2、OsSDG711功能丧失导致水稻器官变小 为了探索OsSDG711在水稻中的功能,作者分别构建了OsSDG711过表达和Ossdg711突变水稻愈伤,每个构建体各选了两株稳定的转基因株系,即SDG711-OE3和SDG711-OE8,Ossdg711-2和Ossdg711-8进行表型鉴定。从苗期到成熟期,Ossdg711-2和Ossdg711-8相对于野生型ZH11表现出矮化、小粒、穗更短更少和粒重减少等多种表型变化。相比之下,SDG711-OE植株具有正常的株高和与WT相似的穗长和粒数,SDG711-OE植株与WT相比没有开花差异,只有略微变小的脱壳籽粒(图2A-2L)。
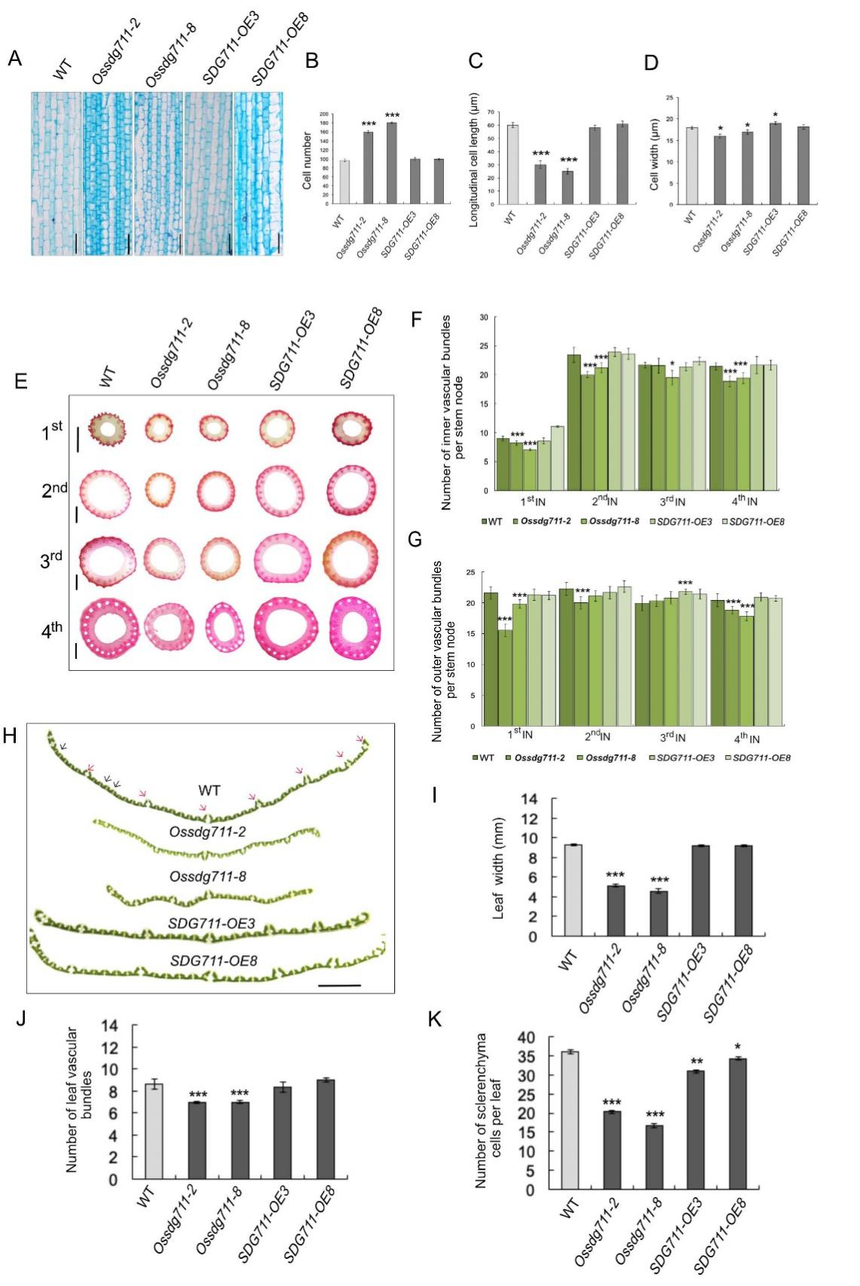
图2. 节间和其他器官的尺寸减小导致Ossdg711植株变小 在节前长度这块,Ossdg711植物的节间明显比WT和OsSDG711-OE植物的节间短且薄(图2E)。当关注第二节间时,观察到Ossdg711植物的节间纵向细胞比WT更短更薄,薄壁组织细胞数更多。然而,OsSDG711-OE植物与WT相比没有表现出明显的差异(图3A-3D)。对节间进行切片观察,与WT相比,Ossdg711植物具有实质上更薄的节间,而OsSDG711-OE植株表现出与WT广泛相似的节间表型(图3E)。此外,Ossdg711植物节间内层和外层的维管束数量明显少于WT(图3F、3G),部分解释了Ossdg711植物的茎相对于WT更细的原因。
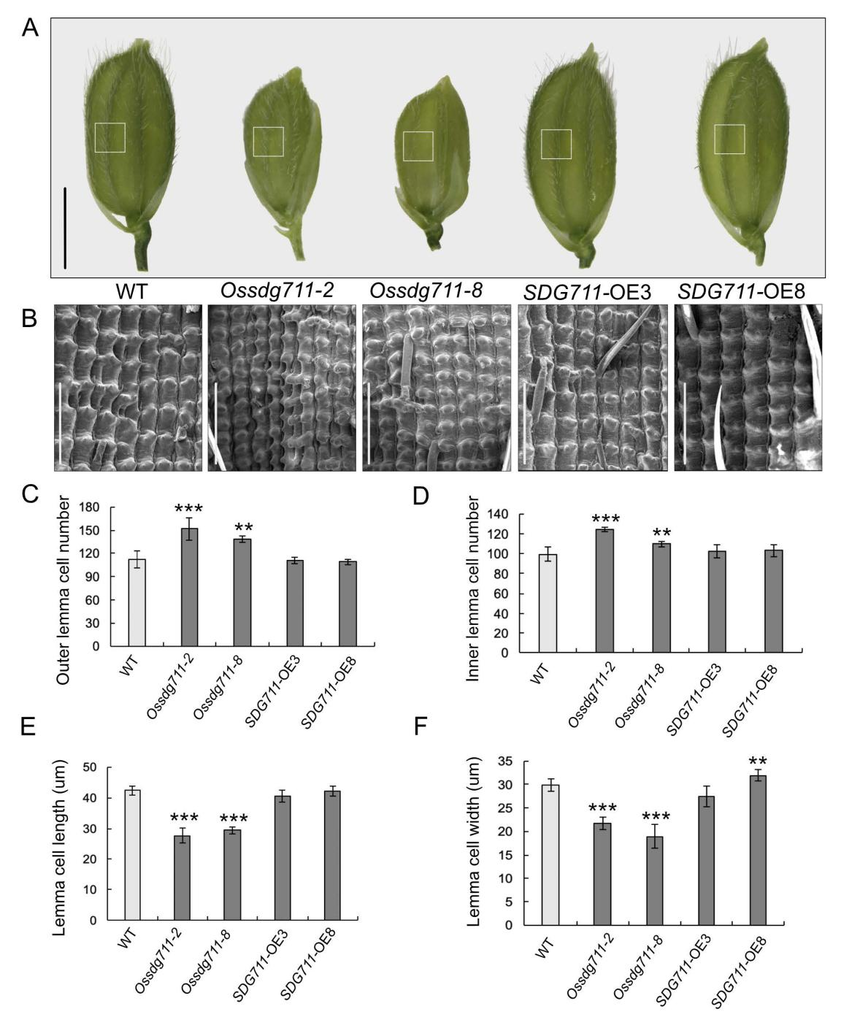
图3. WT、Ossdg711和SDG711-OE植物节间、茎和叶的细胞学观察 Ossdg711突变体还表现出旗叶比野生型的窄,而OsSDG711-OE植株的旗叶宽度与WT相似(图3H)。对灌浆期间的旗叶宽度进行检测,发现Ossdg711植物的叶宽以及大小维管束的数量相对于WT都显著减少(图3I–K)。此外,Ossdg711水稻的籽粒也减小了(图2C、4A)。因此,利用扫描电镜(SEM)检查了WT、Ossdg711和OsSDG711-OE水稻小穗壳的外表皮细胞(图4A、4B)。与WT和OsSDG711-OE植物相比,Ossdg711中外表皮细胞的纵向长度、宽度和数量以及横向宽度和数量显示出显著变化(图4B-4F)。总之,这些结果表明OsSDG711可能调节细胞膨胀和数量,以影响水稻器官大小的发育。
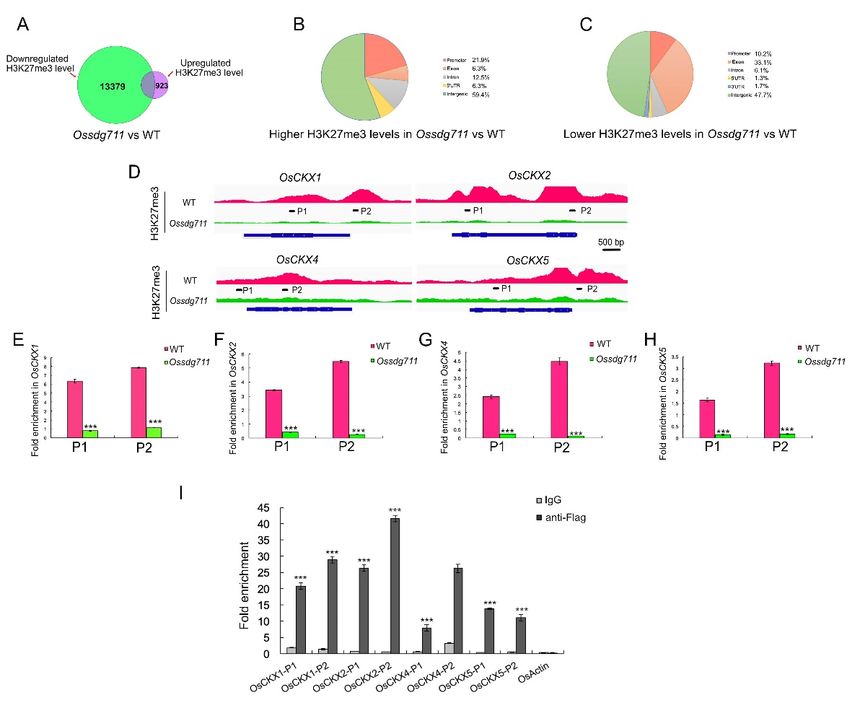
图4. WT、Ossdg711和SDG711-OE植物中小穗壳的组织学分析 3、OsSDG711介导H3K27me3沉积以调节靶基因表达和CK降解 为了鉴定被OsSDG711介导的染色质修饰转录抑制的基因,作者利用WT和Ossdg711幼苗进行了染色质免疫共沉淀后测序(ChIP-seq),共检测到了14302个峰。与WT相比,其中大部分(13379个)在Ossdg711中具有低H3K27me3水平;仅有923个峰,其H3K27me3水平升高(图5A)。H3K27me3水平上调的差异峰中21.9%的位于启动子,6.3%的在CDS,59.4%的位于基因间区(图5B);然而,H3K27me3水平下调的差异峰中,分别有33.1%、10.2%、6.1%和47.7%的位于外显子、启动子、内含子和基因间区(图5C)。 对差异峰关联的基因进行分析,发现了很多转录因子家族成员。比如,上调差异峰中分别有16.7%、5.6%、5.6%和5.6%的属于bHLH、MYB、GRAS和AP2/ERF;下调差异峰中则有7.1%、6.8%和7.9%的AP2/ERF、NAC和bHLH成员。这些结果表明,OsSDG711可能影响几种性状调控基因的表达,使其成为水稻生长发育的潜在重要贡献者。 GO富集分析表明,下调差异峰关联基因主要与“DNA结合”和“调控转录、DNA模板化”相关。KEGG富集的结果,显示这些基因富集在“植物信号转导”和“玉米素生物合成”途径。“玉米素生物合成”类别主要包括CK代谢途径基因,其中大部分OsCKX基因被报道参与调节种子大小和株高。这些结果表明OsSDG711可能靶向这些基因调控水稻器官大小的发育。
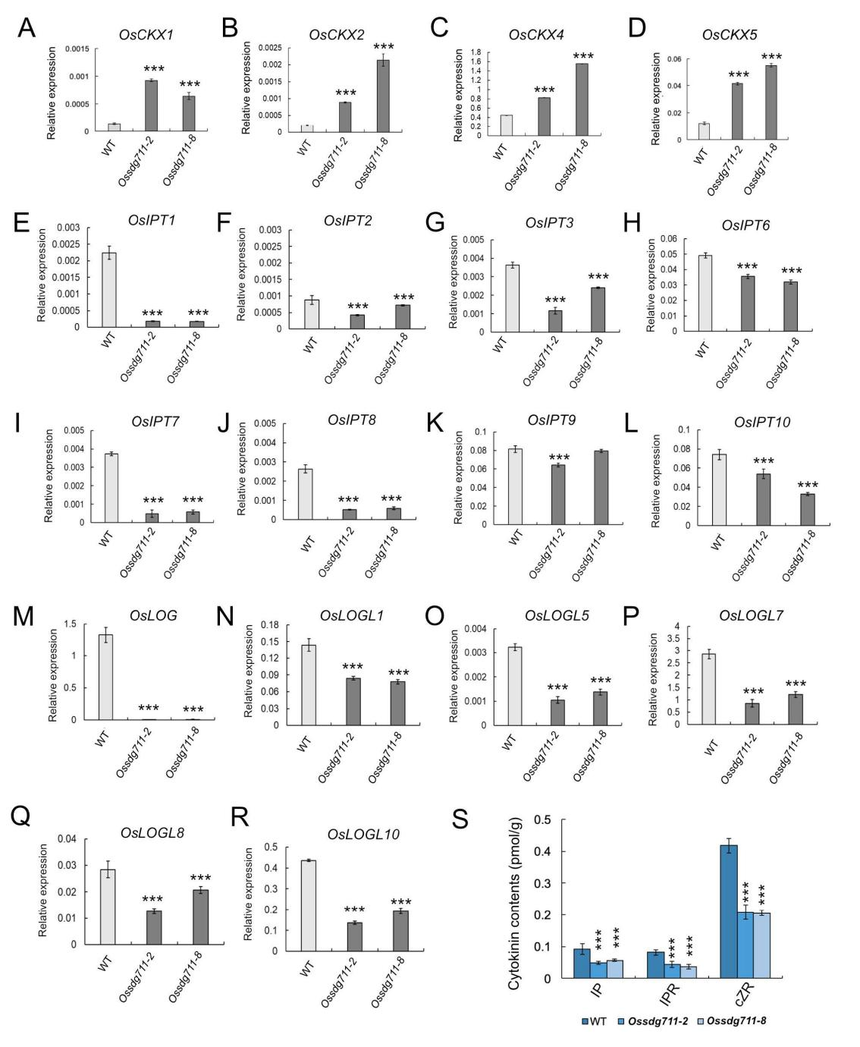
图5. OsSDG711参与OsCKX基因的组蛋白修饰 4、CK代谢相关基因在Ossdg711植物中差异表达 对ChIP-seq数据的检查,发现CKX基因OsCKX1、OsCKX2、OsCKX4和OsCKX5的H3K27me3水平在Ossdg711中相对于WT大幅下调(图5D),并且在Ossdg711和WT节间的ChIP-qPCR结果进一步证实了这些基因座上H3K27me3水平的降低(图5E-5H)。此外,利用RT-qPCR检测了这些基因在Ossdg711和WT节间中的表达水平,观察到它们在Ossdg711中表达升高(图6A-6D),表明OsSDG711抑制CKX基因家族的表达。另外,作者还利用OsSDG711-OE植物进行了ChIP-qPCR,观察到OsSDG711直接结合在这些基因的启动子上。 CKs主要由异戊烯基转移酶(IPTs)和LONELY GUY(LOG)成员合成。RT-qPCR分析显示OsIPT成员(如OsIPT1、OsIPT2、OsIPT3、OsIPT6、OsIPT7、OsIPT8、OsIPT9和OsIPT10) (图6E-6L)和OsLOG成员(如OsLOG、LOG-LIKE1[OsLOGL1]、OsLOGL5、OsLOGL7、OsLOGL8和OsLOGL10)(图6M-6R)在Ossdg711节间的表达水平较低。这一发现表明,OsSDG711表达的减少也间接影响了CK生物合成相关基因的表达。 基于上述发现,作者进一步检测了WT、Ossdg711和SDG711-OE植物茎中的CK水平。相较于WT,Ossdg711中CKs较低,而SDG711-OE中CKs较高,同时OsCKX1、OsCKX2、OsCKX4和OsCKX5的表达也高。 这些数据表明,Ossdg711植物的小器官大小可能与CKX基因的表达增加和CK水平降低有关。
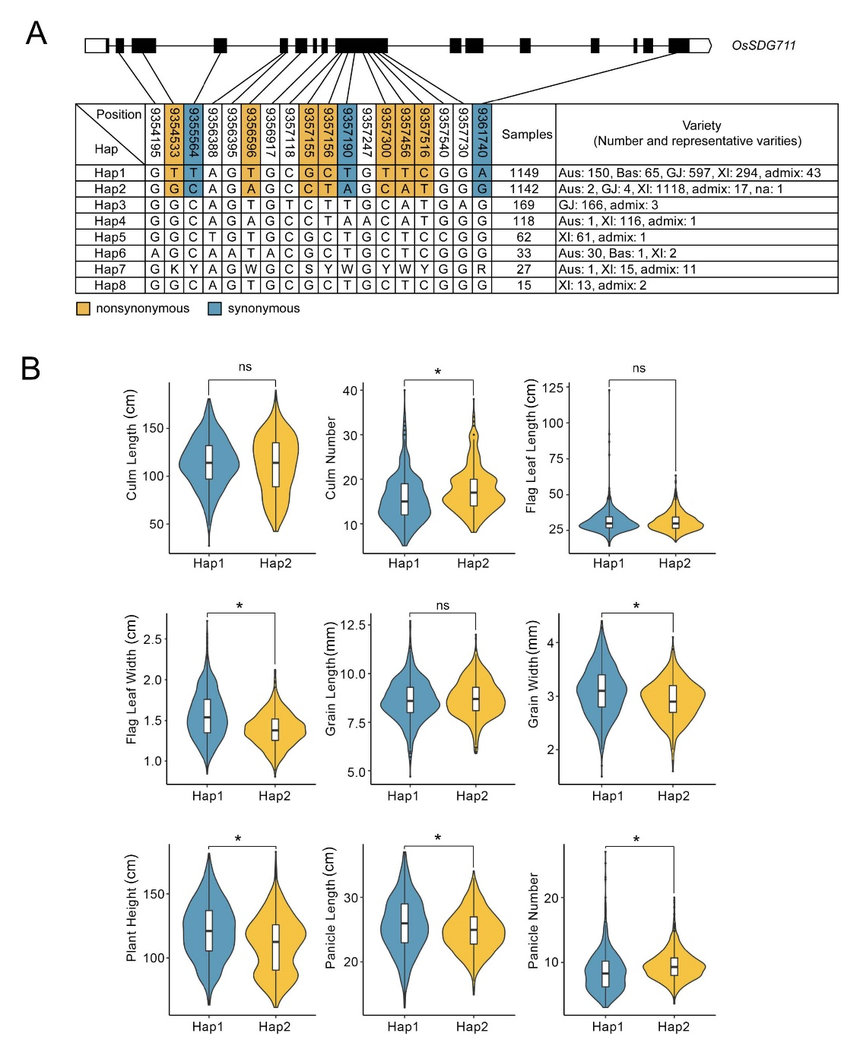
图6. WT和Ossdg711中CK相关基因的表达和CK含量分析 5、OsSDG711编码区的自然变异可能影响水稻的几个农艺性状 为了表征OsSDG711的遗传多样性,作者利用3K水稻基因组计划中的公共数据库分析了该基因的单倍型。在OsSDG711编码区中鉴定了18个单核苷酸多态性(SNPs),并将水稻品种分成了8个单倍型,Hap1和Hap2是两个关键的单倍型,各占水稻全部品种的38%。对这两个显性单倍型的分析表明,它们与许多农艺性状相关。与携带Hap1的品种相比,携带Hap2的品种表现出更大的秆数,但旗叶宽度、粒宽和株高更小(图7B)。进一步的,作者分析了这两个单倍型(Hap1和Hap2)与籼稻(XI)水稻亚种相关表型之间的关系。发现Hap1和Hap2在秆长、旗叶长、旗叶宽、粒宽、株高和穗长表型方面存在显著差异。这些结果表明,这两个单倍型对表型的贡献可能不是由籼粳亚种间的差异引起的,但OsSDG711的序列变异确实有一定的贡献。这些结果也表明,OsSDG711位点的主要单倍型变异在水稻亚种驯化过程中可能具有农艺性状的应用潜力。
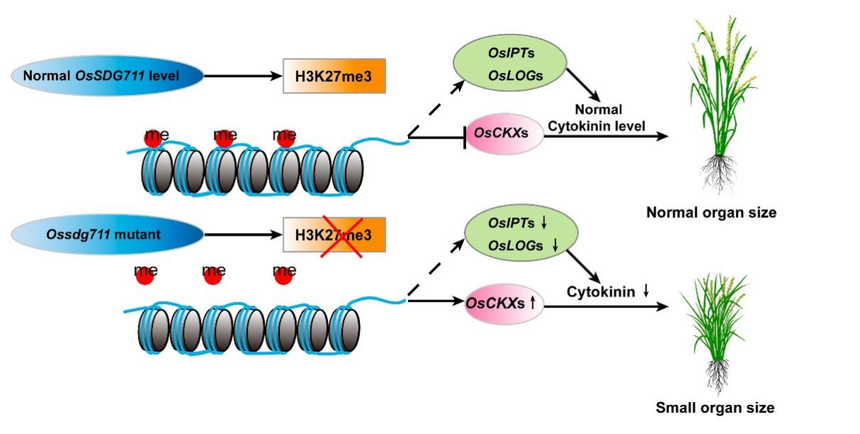
图7. OsSDG711编码区的单倍型分析及其对相关农艺性状表型的影响 结 论 总之,这项研究提供了OsSDG711调控水稻器官大小的表观遗传见解。OsSDG711通过介导H3K27me3水平调节CK降解和生物合成基因的表达,造成CK降解和积累出现差异,从而控制器官发育(图8)。
图8. OsSDG711调控水稻器官大小的工作模型 小编叨叨 组蛋白修饰是一种重要的表观遗传标记,在调控基因表达方面起着重要作用。组蛋白修饰的写入、去除和识别分别由被称为组蛋白writers、erasers和readers的蛋白来完成,暗示这些特定的蛋白质酶类可能通过介导组蛋白修饰来影响基因转录从而调控植物特定的生物学过程。 对组蛋白修饰酶的全面研究一般涉及如下几个方面:
关于我们 爱基百客提供专业的表观遗传技术服务检测,在ChIP-seq上有着丰富经验,协助客户以组蛋白修饰酶为切入点的文章发表在New Phytologist、Plant Communications、Plant Biotechnology Journal、PLos Genetics、Virulence上。
|