NEWS
新闻资讯
|
Neuro-Oncology | IF:15.9 & CUT&Tag和RNA-seq联合解析胶质母细胞瘤的耐药性
发表单位:德克萨斯大学圣安东尼奥分校 发表日期:2023年1月18日 期 刊:Neuro-Oncology(IF: 15.9) 研究技术:CUT&Tag-seq、RNA-seq、RT-qPCR(爱基百客均可提供) 2023年1月18日德克萨斯大学圣安东尼奥分校Gangadhara R. Sareddy研究团队在期刊Neuro-Oncology(IF:15.9)发表了题为 《Lysine-specific histone demethylase 1A (KDM1A/LSD1) inhibition attenuates DNA double-strand break repair and augments the efficacy of temozolomide in glioblastoma》的研究论文。该研究结果表明抑制赖氨酸特异性组蛋白去甲基酶1A(KDM1A)可减弱DNA双链断裂修复通路,并增强替莫唑胺(TMZ)介导的胶质瘤干细胞DNA损伤,与单一治疗相比,KDM1A抑制剂和TMZ联合治疗可提高荷瘤小鼠的生存率。 研究背景 胶质母细胞瘤(GBM)仍然是最常见和最致命的恶性原发性脑肿瘤,目前5年生存率为7.2%。标准治疗包括手术切除大块肿瘤,然后进行体外放射治疗和TMZ辅助化疗。胶质瘤干细胞(Glioma stem cells, GSCs)具有良好的DNA修复能力,能够有效地修复标准治疗引起的DNA损伤,从而产生耐药性。表观遗传修饰因子KDM1A/LSD1在胶质母细胞瘤中高表达,然而,KDM1A在TMZ耐药中的作用机制仍然不清楚。 研究思路
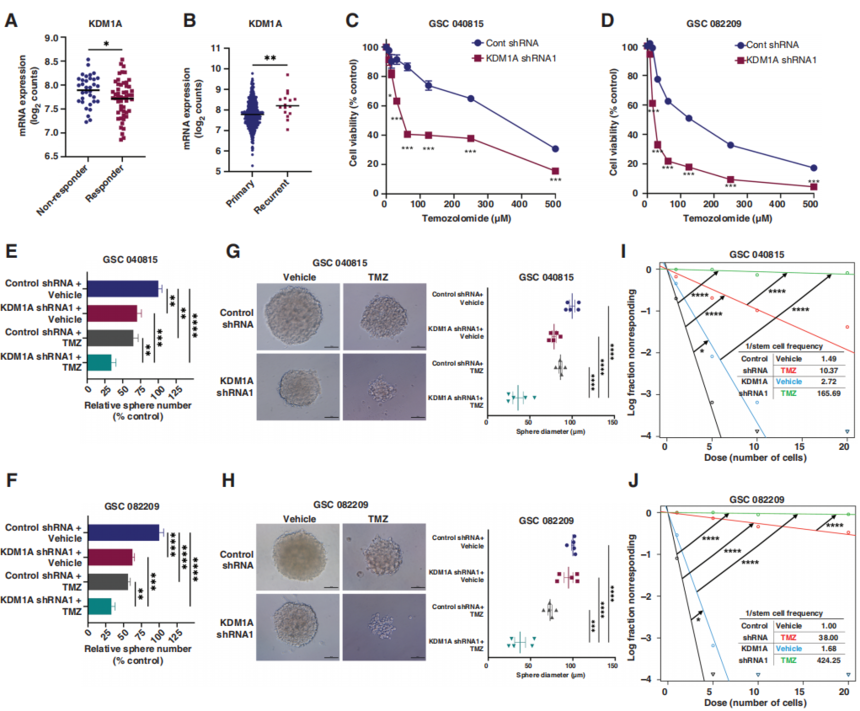
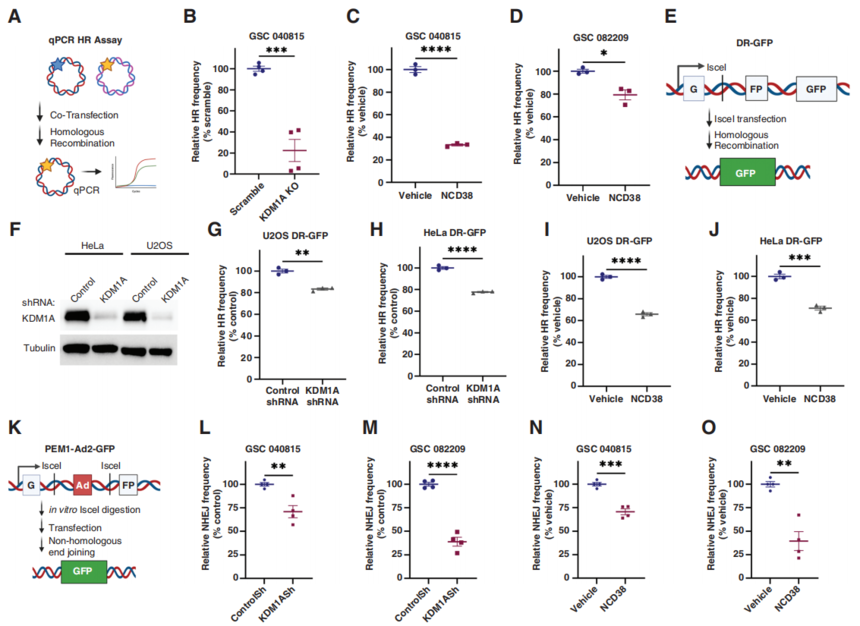
研究结果 1. 敲低KDM1A可增强TMZ在降低GSCs活力、神经球形成和自我更新中的作用 在许多癌症类型中,KDM1A在致瘤性和干性中的重要性已得到强调。在胶质瘤中,与KDM1A低表达人群相比,KDM1A高表达患者的总生存率较低,此外,与非肿瘤样本相比,GBM患者肿瘤表达更高水平的KDM1A。重要的是,在接受标准TMZ/IR治疗的患者中,作者观察到,与有反应的患者相比,无反应的患者表现出更高水平的KDM1A(图1A)。进一步分析表明,与原发肿瘤相比,KDM1A在复发的GBM样本中高表达(图1B)。 作者建立了从德克萨斯大学圣安东尼奥健康科学中心(UTHSA)的GBM患者样本中获得的GSCs的集合。使用这些样本,作者检查了KDM1A是否与耐药表型相关。为了检验这一假设,作者用对照或2种不同的KDM1A特异性shRNA转导患者来源的GSCs,并用增加剂量的TMZ处理它们。细胞活力测定结果显示,与对照相比,KDM1A敲低使GSCs对TMZ敏感(图1C-D)。此外,与各自的对照或单一治疗相比,KDM1A敲低可减少TMZ治疗的GSCs的神经球形成(图1E-F)、神经球生长(图1G-H)和自我更新能力(图1I-J)。重要的是,使用诱导型CRISPR/Cas9系统生成的KDM1A敲除(KO) GSCs验证了这些发现。细胞活力测定结果表明,KDM1A-KO显著使GSCs对TMZ治疗敏感。有趣的是,在KDM1A-KO细胞中重新引入KDM1A显著逆转了这种效应。此外,作者使用已知TMZ敏感(U251)、TMZ耐药(T98G)和获得性TMZ耐药(U251 TMZ-R)GBM系的细胞活力和克隆生成研究验证了这些发现。总之,这些发现表明KDM1A与耐药表型相关,并且KDM1A基因敲低增强了TMZ在GSCs的疗效。
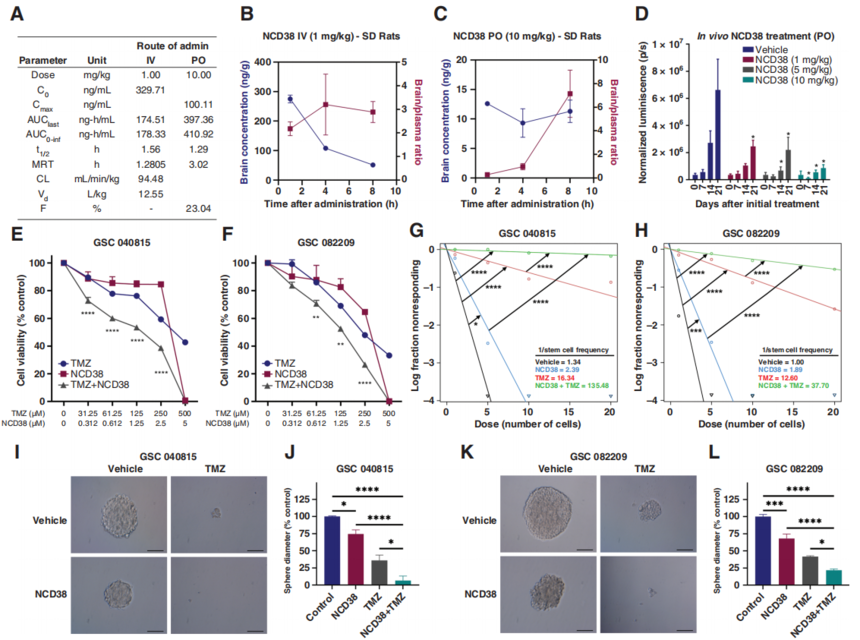
图1. KDM1A敲低使GSCs对TMZ治疗敏感。 2. NCD38是一种脑渗透性KDM1A抑制剂,可增强TMZ在GSCs中的疗效 最近,作者的研究小组发现了一种新的KDM1A特异性抑制剂NCD38,它比其母体化合物2-PCPA更有效地选择性抑制KDM1A,并在几种癌症模型中显示出抗肿瘤活性。接着作者在雄性Sprague Dawley大鼠中静脉注射(IV)和口服NCD38后进行了药代动力学和脑生物利用度研究。两种给药途径均显示出良好的NCD38在血浆中的药代动力学参数(图2A),口服的生物利用度为23%,每个病例的半衰期接近2小时(图2A)。重要的是,NCD38在大脑和血浆中均可获得(图2B, C),在静脉注射和口服给药后8小时,总脑/血浆比率超过2,表明NCD38易于渗透血脑屏障(BBB)并表现出足够的脑生物利用度。此外,作者使用U251-GSC原位小鼠模型进行了剂量范围(1mg/kg, 5mg/kg或10mg/kg)的研究。结果显示,10mg/kg是抑制肿瘤生长最有效的剂量(图2D)。 接下来,作者研究了KDM1A特异性抑制剂NCD38是否会增强TMZ介导的细胞活力降低。与KDM1A敲低相似,NCD38处理的GSCs对TMZ的敏感性高于单独治疗。接下来,作者研究了KDM1A特异性抑制剂NCD38是否增强了TMZ介导的细胞活力降低。与KDM1A基因敲除相似,NCD38处理的GSCs对TMZ的敏感性高于单独使用TMZ(图2E,F)。联合指数分析表明,NCD38处理与TMZ具有协同作用。重要的是,KDM1A的敲除显著降低了GSCs中NCD38的活性。此外,与单一治疗相比,联合治疗显著降低了GSCs的自我更新和神经球形成能力(图2G-L)。这些结果表明,NCD38与TMZ协同作用,降低了GSCs的活力和自我更新。
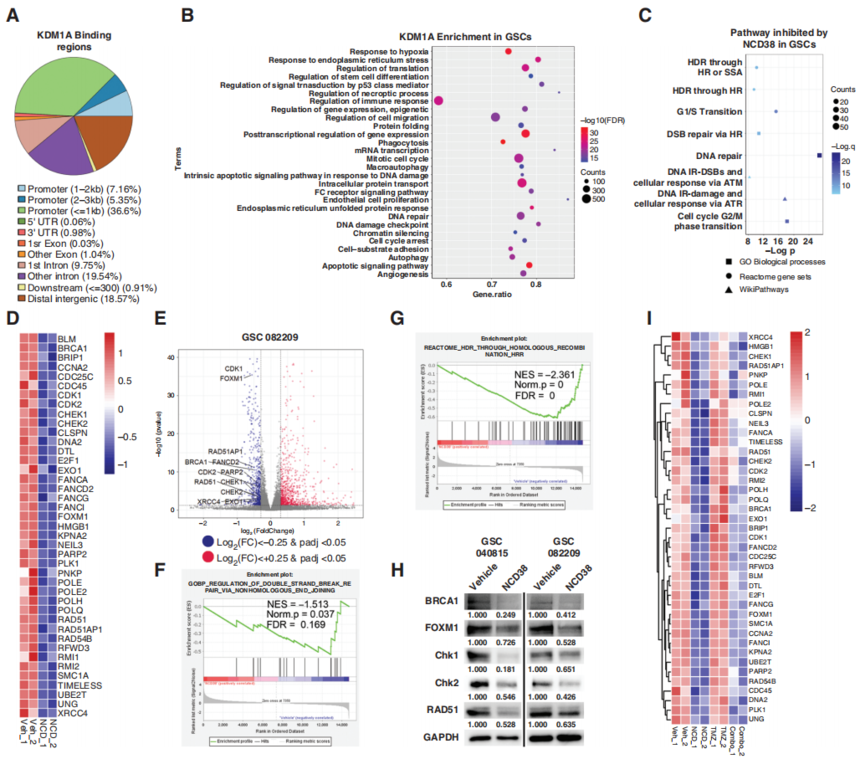
图2. 脑渗透性KDM1A抑制剂 NCD38可协同增强TMZ介导的细胞活性和GSCs自我更新的降低。 3. KDM1A富集于DNA DSB修复基因的转录起始位点 为了了解KDM1A抑制如何使GSCs对TMZ敏感的机制,作者使用CUT&Tag-seq进行了GSCs中KDM1A的全基因组定位研究。作者在GSCs基因组中检测到75491个KDM1A峰(P<0.0001)(图3A)。在这些峰中,大多数(49.11%)位于启动子区域。具体来说,36.6%位于转录起始位点两侧的1kb区域,KDM1A峰位于基因间区和内含子区域,分别占18.57%和29.29%。重要的是,利用GO对KDM1A结合基因进行通路分析显示,KDM1A结合基因在DNA修复、细胞周期和UPR信号通路中富集(图3B)。由于TMZ抗性表型与DNA修复增强有关,作者接下来检查了DNA修复基因上KDM1A特异性富集。作者的研究结果表明,KDM1A在许多DNA修复基因的转录起始位点高度富集。作者用ChIP验证了KDM1A与特定基因启动子的结合,表明KDM1A可能通过直接募集到启动子区域来调节它们的表达。
图3. CUT&Tag和RNA-seq分析发现KDM1A抑制可抑制DNA修复基因的表达。 4. KDM1A抑制或敲除减少参与DNA修复的基因的表达 由于GSCs具有较高的DNA修复能力,这是TMZ治疗耐药的主要因素,作者假设KDM1A抑制介导的TMZ敏感性可能与DNA修复基因的衰减有关。作者通过RNA-seq检测了使用载体、NCD38或TMZ单一疗法或两者联合处理的GSCs的整体转录变化。作者首先研究了NCD38单药治疗的效果,以及NCD38治疗的GSCs中与DNA修复和细胞周期相关的下调途径(图3C)。对差异表达基因的进一步检查显示,几个重要的DNA修复基因下调(图3D-E)。重要的是,GSEA分析表明,NCD38处理的细胞中改变的基因与HR和NHEJ修复途径的基因集呈负富集(图3F-G)。进一步分析表明,NCD38处理增加了DNA修复基因子集启动子区域抑制性组蛋白甲基化标记H3K9me2的富集。 为了进一步验证KDM1A对GSCs中DNA修复途径的影响,作者使用KDM1A-KO GSCs进行了RNA测序,并将其与NCD38处理的细胞进行了比较。结果表明KDM1A-KO、KDM1A-KD和KDM1A抑制都会导致GSCs中DNA DSB修复基因的下调。作者还观察到,与NCD38组相比,KDM1A-KO组有更多的基因发生改变,这可能在一定程度上反映了KDM1A以去甲基酶依赖和独立的方式调节基因表达的能力,而NCD38只抑制KDM1A去甲基酶依赖的基因表达。 为了进一步了解NCD38和TMZ在GSCs中联合作用的机制基础,通过无监督聚类将差异表达基因细分为4个主要簇。A3簇包含140个由TMZ诱导但被NCD38抑制的基因。GO分析表明,这些基因主要富集于细胞对DNA损伤刺激的反应、DNA重组、DNA修复和HR(图3I)。A4簇包括420个由NCD38和TMZ联合处理协同诱导的基因,涉及细胞死亡和自噬。此外,A2簇包括646个在联合治疗中协同抑制的基因,其中一些涉及细胞周期、上皮向间质转化、E2F、mTORC1和MYC信号传导。总之,这些结果表明,KDM1A的抑制有助于DNA修复基因的衰减。 5. KDM1A抑制可抑制GSCs中的HR和 NHEJ 由于RNA-seq和CUT&Tag-seq结果表明KDM1A在DNA DSB修复中发挥作用,作者检查了KDM1A抑制对GSCs DNA修复能力的影响。先前的研究表明,HR和NHEJ修复能力是GBM治疗耐药的原因。为了确定KDM1A敲低或抑制对HR和NHEJ修复试验的影响,作者首先在GSCs中使用了基于qPCR的HR测定(图4A),发现KDM1A敲除或抑制显著降低了GSCs中的HR能力(图4B-D)。接下来,在U2OS和HeLa细胞系中使用众所周知的HR特异性DR-GFP报告系统测量HR效率(图4E)。在这些模型中,KDM1A敲低或NCD38处理也显著降低了HR效率(图4F-J)。此外,作者探讨了NHEJ能力是否受到KDM1A敲低或抑制的影响(图4K)。正如测序结果所预测的那样,敲低或抑制KDM1A会降低GSCs的NHEJ能力(图4L-O)。总之,这些结果高度表明KDM1A促进了GSCs的HR和NHEJ修复活性。
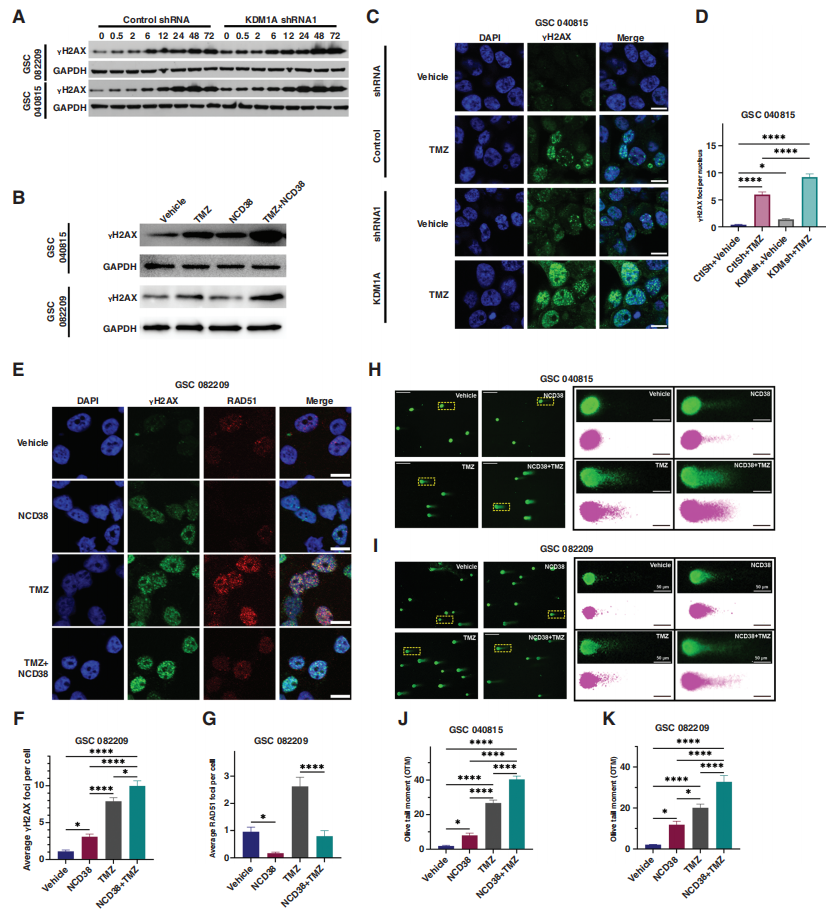
图4. KDM1A抑制会减少GSCs的同源重组(HR)和非同源末端连接(NHEJ)修复。 6. KDM1A抑制增强TMZ介导的GSCs DNA损伤 由于KDM1A抑制损害了GSCs的DNA修复能力,作者接下来研究了这种HR和NHEJ修复能力的衰减是否会导致持续的DNA损伤信号传导和未修复的双链断裂。首先,作者测量了KDM1A敲低、敲除和NCD38与TMZ联合处理的GSCs中γH2AX焦点的形成。在基础条件下,敲低KDM1A增加了γH2AX水平(图5A)。与对照shRNA细胞相比,TMZ进一步处理显著增加了KDM1A KD细胞中的γH2AX水平,这在NCD38和TMZ联合处理中得到了证实(图5A, B)。此外,敲低或药物抑制KDM1A显著增加了GSCs中γH2AX焦点的形成(图5C-F)。 接下来,作者评估了RAD51病灶的形成,这是一种HR修复的标记物,其抑制作用会使胶质瘤细胞对烷化剂敏感。正如预期的那样,TMZ治疗促进了RAD51病灶的形成,然而,当与NCD38联合处理时,观察到TMZ诱导的GSCs中RAD51病灶的形成明显减弱,这与测序结果一致,并支持NCD38损害HR的作用(图5E-G)。此外,评估了53BP1病灶的形成,这是NCD38处理后GSCs中DNA DSB修复和NHEJ的标志,发现TMZ处理增加了53BP1病灶的形成,然而,当与NCD38联合处理时,发现TMZ诱导的53BP1病灶形成的明显衰减,这与作者的报告分析一致,支持NCD38减少GSCs中NHEJ修复的作用。此外,通过碱性彗星试验测量了联合治疗对DNA损伤的影响,发现与单一治疗相比,联合治疗显著增加了处理过的GSCs的橄榄尾矩(图5H-K)。因此,这些结果提供了强有力的证据,即KDM1A抑制降低了GSCs修复TMZ介导的DNA损伤的能力。
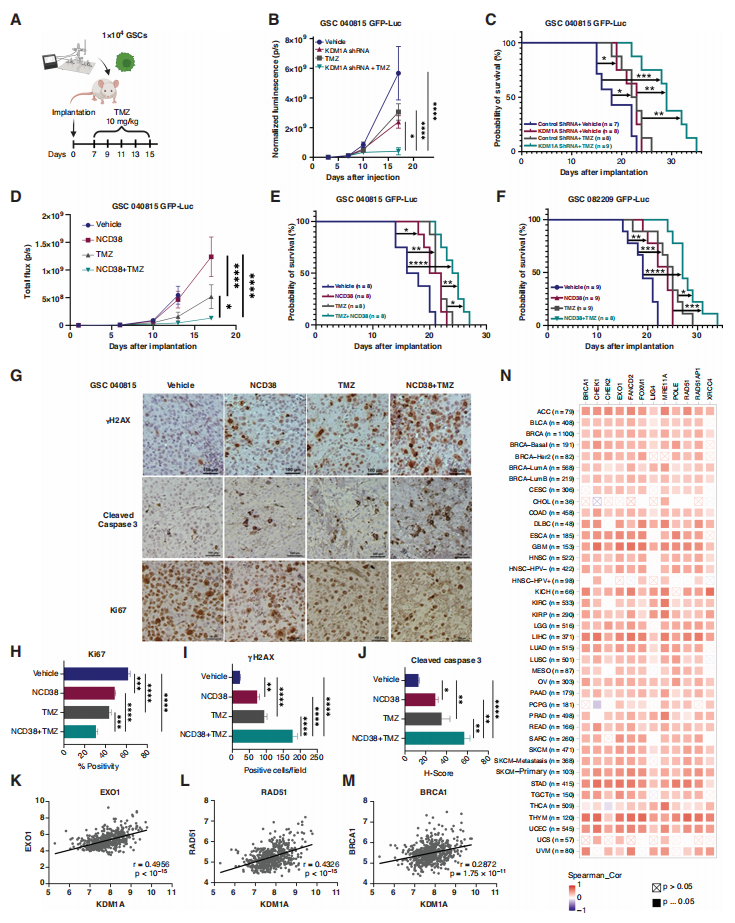
图5. KDM1A抑制增强GSCs中TMZ介导的DNA损伤。 7. KDM1A敲低或抑制可增强TMZ在异种移植模型中的疗效 为了确定KDM1A是否是增强TMZ疗效的潜在靶点,作者将经对照shRNA或KDM1A shRNA转导的患者来源的GSCs注射到NOD-SCID小鼠的右脑(图6A)。结果发现,与对照组相比,TMZ治疗显著降低了肿瘤进展,提高了KDM1A敲低的荷瘤小鼠的存活率(图6B-C)。接下来,为了确定KDM1A抑制剂NCD38与TMZ联合使用是否能提高总生存时间,作者用NCD38、TMZ或联合治疗患者来源的GSC 040815、GSC 082209和U251 GSCs荷瘤小鼠。如图所示,与单一治疗相比,NCD38和TMZ联合治疗在所有肿瘤模型中均可显著降低肿瘤进展(图6D),并提高总生存时间(图6E, F)。肿瘤切片免疫组化分析显示,联合治疗后,增殖标记物Ki67显著降低(图6G-H),凋亡标记物cleaved caspase3和DNA DSB标记物γH2AX显著增加(图6G, I-J),这些发现与使用KDM1A敲低肿瘤样本获得的数据一致。这些结果表明,KDM1A基因敲低或抑制剂处理显著增强了TMZ的疗效,并改善了GSCs荷瘤小鼠的总生存时间。 为了进一步了解KDM1A在人GBM样本DSB修复中的临床关联,作者分析了公开可用的TCGA患者数据库。KDM1A与几种DNA修复基因之间存在正相关关系,但是这些基因在NCD38处理后被减弱,包括EXO1、RAD51和BRCA1(图6K-M)。有趣的是,不仅在GBM中,而且在其他几种癌症类型中也观察到类似的趋势(图6N)。总之,这些数据提供了临床前证据,表明KDM1A抑制增强了TMZ在提高小鼠GBM模型存活率方面的功效。
图6. KDM1A敲低或抑制与TMZ组合可提高荷瘤小鼠的存活率。 结 语 在本研究中,作者检测了KDM1A抑制是否能增强TMZ在GBM中的疗效,并探讨了其作用机制。总之,作者的研究结果证实,KDM1A抑制剂可通过抑制DNA DSB修复途径,在体外和体内增强TMZ对GSCs的疗效,而TMZ 和KDM1A抑制剂NCD38的联合可能是治疗GBM的一种新型治疗策略。 原文链接:https://doi.org/10.1093/neuonc/noad018 · 关于我们 · 爱基百客专注于提供领先表观组学服务。公司先后引入ChIP、CUT&Tag、WGBS、ATAC-seq、全转录组、10x Genomics、DNBSEQ-T7等实验平台,不断提升公司的科研服务能力。至今合作的科研客户超2000家,涵盖国内知名科研院所、高校以及相关生物企业,科研成果曾多次在Cancer Cell、Nature Communications、J HEMATOL ONCOL、Plant Cell 等国际高水平学术期刊发表,受到了客户广泛好评,是国内成长最迅速的高通量测序科研服务企业之一。 · CUT&Tag相关介绍 · CUT&Tag是检测靶蛋白和DNA互作的新方法,拥有背景低、信号强,步骤简单,细胞起始量低,重复性好等优势。常用于研究组蛋白修饰和转录因子研究。爱基百客可提供: · CUT&Tag测序分析 Peak分析:Peak注释和分布分析,Peak关联基因的GO、KEGG的注释和富集分析, 转录因子和Motif分析等。 多样本差异分析:差异 Peak 分布分析,差异 Peak 关联基因的 GO、KEGG 功能注释与富集,转录因子预测,Motif预测等。 · 爱基百客CUT&Tag三大优势 优势一:爱基百客具有丰富的项目经验。包括人(乳腺癌、肠癌、肾等)、小鼠、猪、蜜蜂、水稻、大豆、拟南芥、白菜、白叶枯病菌等50+物种经验,不同组织类型(胚胎、肾、卵巢、子宫、脑、甲状腺、胰腺、脾脏、淋巴结和肝等组织类型)具有相关经验; 优势二:可提供前期实验设计、测序、分析以及后期验证(ChIP、EMSA)一站式服务; 优势三:强大的生信团队,满足客户各种数据挖掘和分析需求。
精选合集,欢迎收藏哟! |