NEWS
新闻资讯
|
J BIOMED SCI | MeRIP-seq助力解析m6A修饰在EBV裂解再激活过程中的重要性mRNA最常见的内部修饰包括N6-腺苷酸甲基化(m6A)、N1-腺苷酸甲基化(m1A)、胞嘧啶羟基化(m5C)等。其中,m6A是高等生物mRNA和lncRNAs上最为普遍的修饰,此外microRNA、circRNA、rRNA、tRNA和snoRNA上都有发生m6A修饰。m6A修饰主要发生在RRACH序列中的腺嘌呤上,其功能由“Writers、Erasers和Readers”决定。 近年来,m6A修饰的研究热情居高不下,大量研究发现其广泛参与肿瘤疾病的发生和发展以及植物的生长发育。由于其重要性,也成为了现在国自然基金项目、科研顶刊和临床研究的热点方向。 目前,MeRIP作为研究m6A的重要手段之一,已广泛应用于各种研究。本期我们带来了一篇来自宾夕法尼亚大学佩雷尔曼医学院的研究,帮助大家拓展研究思路。
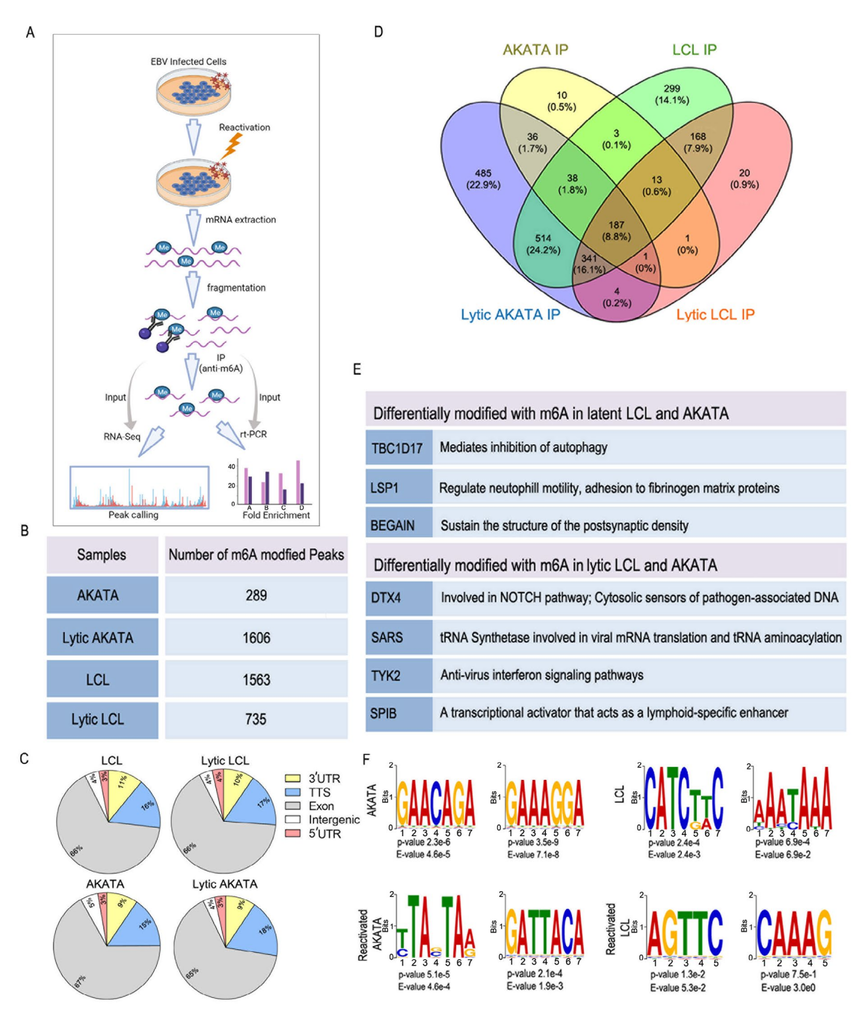
2023年宾夕法尼亚大学佩雷尔曼医学院Bose Dipayan等研究团队在期刊Journal of biomedical science(IF:11)发表了题为“Attenuation of lFN signaling due to m6A modification of the host epitranscriptome promotes EBV lyticreactivation”的研究论文。该研究结果表明:m6A修饰在EBV再激活过程中克服先天免疫反应的重要性。在裂解再激活过程中,EBV以宿主的RNA甲基化系统为目标,通过抑制干扰素信号来减弱先天免疫反应,从而促进病毒的成功裂解复制。 研究背景 m6A修饰是一种调节mRNA代谢的RNA修饰。有报道表明,m6A修饰影响EBV编码mRNA的稳定性和代谢。然而,再激活对细胞mRNA重编程的影响,以及这如何有助于成功诱导裂解再激活尚不清楚。 细胞焦亡 1. 采用RNA甲基化免疫沉淀测序(MeRIP-seq)和RNA-seq对差异甲基化靶点进行筛选和验证。 2. 采用Western blotting、RT-qPCR和免疫荧光检测不同蛋白的表达和定位。 3. RNA稳定性和多体分析检测下游基因的半衰期和翻译效率。 4. 通过插入点突变破坏m6A甲基化位点来验证m6A甲基化对其稳定性和表达水平的影响。 研究结果 参与该途径的细胞mRNA差异甲基化可以控制EBV再激活引起的IFN信号反应。 ebv潜伏期和再激活期间,对EBV阳性LCL和Akata细胞分离的RNA进行了MeRIP-seq分析,发现了从数百到1600多个不同数量的甲基化峰(图1B)。进一步分析了潜伏和裂解复制之间基因的差异甲基化,发现在LCL和Akata中,与潜伏(3个mRNA)相比,裂解再激活过程中共有7种不同的细胞mRNA(4个mRNA)发生了差异甲基化(图1D和E)。针对唯一甲基化的基因进行了通路分析,与潜伏细胞相比,在裂解型EBV阳性细胞中,TYK2和DTX4基因都被高甲基化,这两个基因是IFN信号通路中的关键基因。
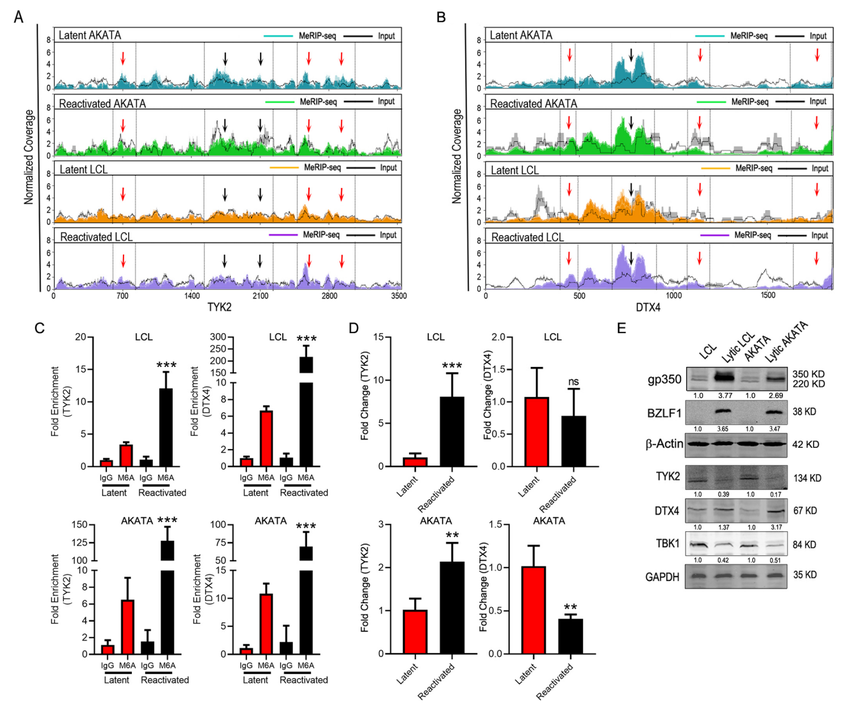
图1 EBV的裂解再激活改变了宿主细胞转录物的m6A修饰。 EBV裂解再激活诱导TYK2和DTX4 mRNA的超甲基化 DTX4靶向TBK1,并导致其泛素介导的蛋白体降解。TBK1负责IRF3的磷酸化,导致IRF3易位到细胞核,激活IFN应答基因,从而促进干扰素信号传导。同样,酪氨酸激酶2 (TYK2)与干扰素受体的细胞质结构域相互作用,导致下游分子磷酸化,从而激活干扰素应答。在裂解再激活过程中,作者观察到DTX4和TYK2 mRNA中的特定超甲基化区域(图2A, B)。为了在蛋白水平上确定mRNA的高甲基化与TYK2和DTX4表达之间的联系,在BJAB细胞中从异源启动子表达它们的cDNA,并在BJAB细胞中独立敲除m6A writer METTL14,并监测到TYK2表达下调和DTX4表达上调的水平。进一步证实METTL14过表达和沉默对TYK2和DTX4 mRNA甲基化的影响,进行RT-qPCR发现过表达METTl14导致更高倍的富集,而沉默导致TYK2和DTX4 mRNA的富集降低。
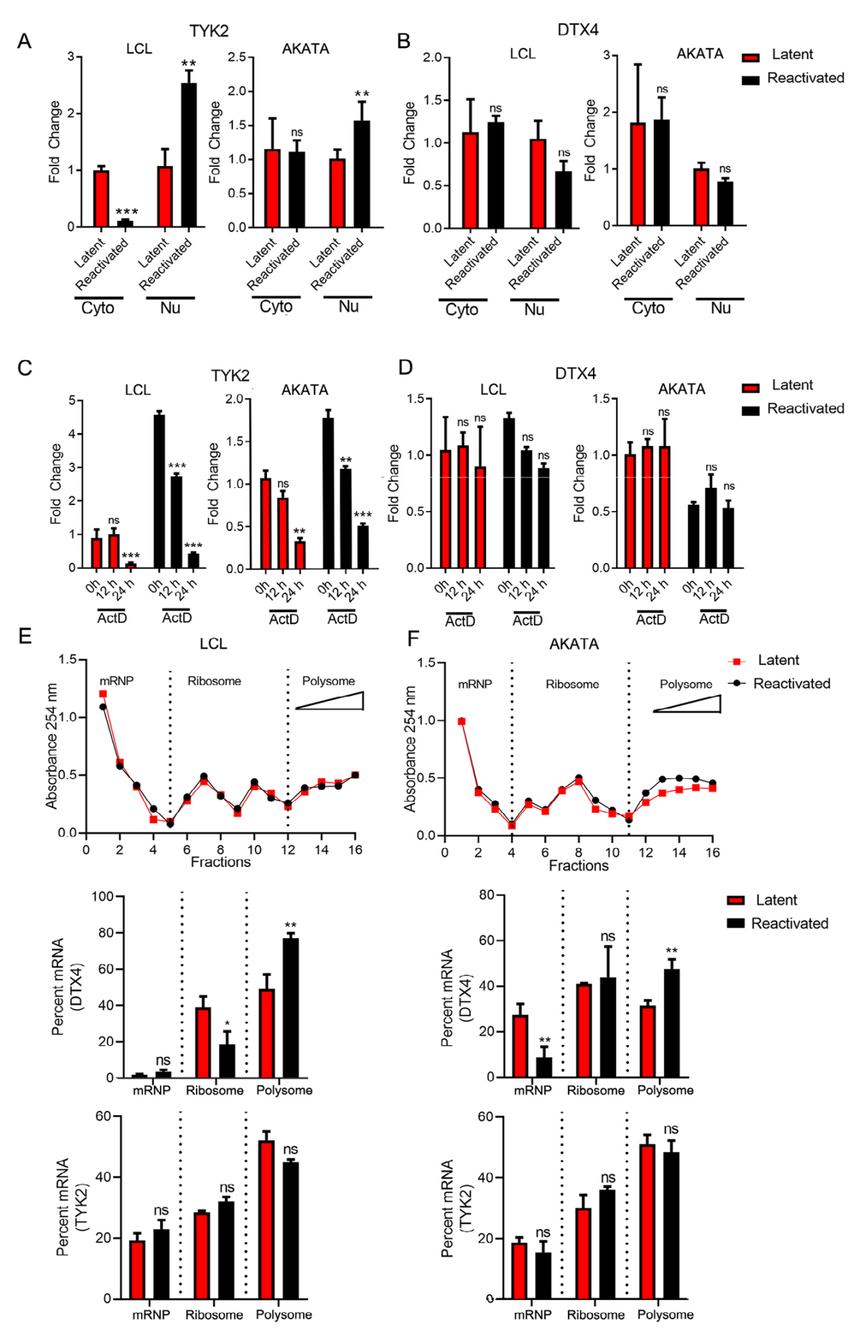
图2 EBV的裂解再激活改变了TYK2和DTX4 mRNA的m6A修饰 TYK2和DTX4的m6A修饰控制mRNA的代谢 m6A修饰与一系列细胞过程有关,包括细胞核RNA输出、稳定性、降解和核糖体结合改变,这些过程最终导致mRNA代谢和相关蛋白表达的改变。为了确定m6A修饰是否对DTX4和TYK2 mRNA稳定性有影响,在不同时间点用放线菌素D (ActD)处理潜伏和再激活的LCL和Akata细胞。ActD是一种有效的转录抑制剂,可关闭全长mRNA转录物的形成。实验发现潜伏细胞中TYK2 mRNA水平在24小时内显著降低,但在再激活细胞中,两种细胞系在处理12小时后均显著降低(图3C)。在LCL或Akata细胞中,潜伏细胞和再激活细胞在ActD处理期间,DTX4 mRNA水平没有明显变化(图3D)。再激活过程中细胞质中TYK2 mRNA水平的下降(图3A),ActD处理过程中mRNA稳定性的降低(图3C)导致TYK2 RNA在再激活过程中可能成为细胞质中降解的目标。
图3 m6A甲基化改变了TYK2和DTX4 mRNA的代谢 在EBV再激活过程中,DTX4 mRNA的m6A被高甲基化,这促进了它与多聚体的关联,并随后导致蛋白水平的增加。 前面结果说明m6A修饰的mRNA与多核糖体形成相关,并使用在线程序SRAMP预测了DTX4基因上m6A修饰的不同基序。m6A在mRNA上的分布具有特异性,据报道甲基化的腺苷位于rach或DRACH基序,进一步验证了这两个特定区域是否被甲基化,以及点突变是否会破坏基序导致这些区域甲基化标记的去除。结果表明DTX4基因中rach基序的突变导致DTX4 mRNA甲基化的显著降低。进一步证实了myc-DTX4在LCL细胞中蛋白水平的表达(图4D)。在表达野生型DTX4的细胞中,mycDTX4的水平在再激活过程中升高。此外,在再激活过程中,突变myc-DTX4的水平明显低于表达野生型myc-DTX4的细胞水平(图4D)。在EBV再激活过程中,DTX4 mRNA的m6A被高甲基化,这促进了它与多聚体的关联,并随后导致蛋白水平的增加。
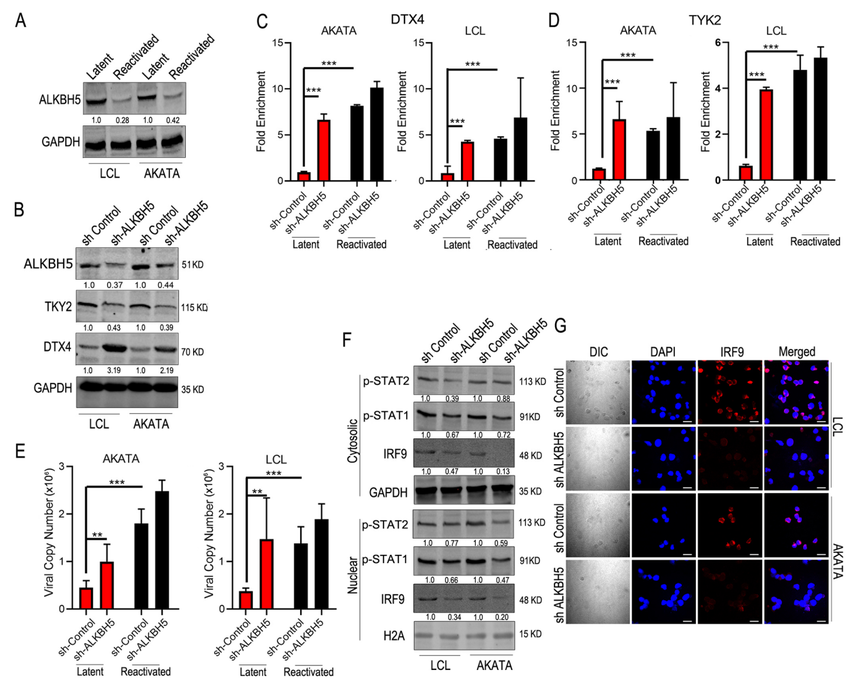
图4 m6A甲基化改变了TYK2和DTX4的蛋白表达 YTHDF2是负责TYK2 mRNA稳定性和降解的关键调控分子。 YTHDF2是识别mRNA上的m6A甲基化并通过与CCR4-NOT和P/MRP复合物相互作用诱导其降解来调节其稳定性的阅读器蛋白。使用针对YTHDF2蛋白的抗体进行RIP,然后对LCL细胞中的TYK2转录物进行rtPCR。与潜伏感染的LCL细胞相比,再激活细胞中TYK2转录本的富集程度显著增加了两倍(图4E)。这些数据强烈表明,与潜伏感染的细胞相比,在再激活过程中,更多的TYK2 mRNA与YTHDF2结合。 为了进一步确定YTHDF2在TYK2 mRNA降解中的作用,监测了潜伏感染和再激活后YTHDF2沉默后TYK2的蛋白水平。当在LCL中使用YTHDF2特异性shRNA慢病毒敲除YTHDF2时,潜伏细胞和再激活细胞中的TYK2水平都得到了恢复(图4F)。进一步用放线菌素D处理YTHDF2敲低细胞并使其重新激活。使用m6A特异性抗体免疫沉淀RNA,然后使用TYK2特异性引物进行RT-qPCR。研究观察到在TYK2敲除细胞的再激活过程中,与sh-对照细胞相比,显著富集(图4G)。这一发现表明TYK2 mRNA在YTHDF2敲除后稳定并积累。这些结果强烈表明,YTHDF2是负责TYK2 mRNA稳定性和降解的关键调控分子。 在再激活过程中,TYK2 mRNA的高甲基化增强了其与YTHDF2的结合,从而导致其mRNA的降解和抑制IFN的反应,从而增强病毒裂解复制。 为了证明TYK2和DTX4直接参与IFN信号通路的调控,作者使用shRNA特异性慢病毒构建体在LCL细胞中沉默TYK2和DTX4,分析STAT1、2和IRF3磷酸化水平。观察到TYK2细胞中STAT1和STAT2的磷酸化水平显著降低,而DTX4 KD细胞中p-IRF3的磷酸化水平升高(图4B,C)。在再激活时,DTX4的沉默导致IFN-α和β的上调,而TYK2的沉默则具有相反的效果(图4D,E)。由于TYK2是IFN信号通路的关键中间效应分子之一,而IFN信号在再激活过程中对病毒基因组拷贝数有直接影响,因此测定了IFN-α和IFN-β的mRNA水平(图4H,I)。结果表明,当YTHDF2被敲除时,潜伏细胞和再激活细胞中的IFN-α和IFN-β水平均升高。当YTHDF2被沉默时,IFN-α和IFN-β水平的显著上调也与随后病毒拷贝数的减少相关(图4J)。进一步证明了在EBV再激活过程中,IFN-β mRNA不会通过直接m6A甲基化而显著降解。 ALKBH5在病毒再激活过程中抑制IFN反应 为了确定ALKBH5在EBV再激活中的作用,在ALKBH5沉默的细胞中进行了m6A甲基化的MeRIP和rtPCR。结果表明,在潜伏细胞中沉默ALKBH5时,TYK2和DTX4 mRNA的甲基化富集程度明显更高(图5C, D),并且在LCL和Akata细胞中是一致的。这一数据有力地表明ALKBH5在潜伏期负责甲基化标记的去除。沉默ALKBH5后,即使在潜伏感染期间,病毒拷贝数也显著增加(图5E)。与sh-对照相比,sh-ALKBH5 KD LCL细胞在再激活过程中IFN-α/β水平显著降低(图5 A)。为了进一步探索ALKBH5沉默时IFN通路的下游信号活动,还监测了细胞质和细胞核中IRF9、STAT1和STAT2的水平。结果显示STAT1和2的磷酸化水平较低(图5F),western blot和免疫荧光信号显示IRF9的表达水平显著降低(图5F和G)。
图5 ALKBH5对干扰素信号传导的影响 研究总结 在EBV再激活过程中,m6A去甲基化酶ALKBH5显著下调,导致细胞转录本DTX4和TYK2的甲基化增强,从而导致TYK2 mRNA的降解和DTX4 mRNA的更高翻译效率,这导致IFN信号的衰减,从而促进病毒裂解复制的进展。此外,抑制这些转录本的m6A甲基化会导致IFN的产生增加,并大幅减少了病毒拷贝数。该篇研究提出了EBV在裂解再激活过程中调节宿主细胞免疫系统的新机制。 目前,研究m6A可以采用MeRIP-seq,该技术通过特异识别m6A修饰的抗体,对细胞内具有m6A修饰的RNA片段进行免疫共沉淀。结合高通量测序和生物信息学分析,可在全基因组范围内对m6A修饰的状况进行系统研究。具有灵活度高、检测范围广、精确度高和适合大部分物种的优点。 爱基百客专注于表观遗传服务,提供MeRIP-seq从方案设计-测序-分析-验证的一站式服务。有相关需求的老师欢迎联系我们,与我们沟通交流。
项目咨询 了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! 项目文章集锦 ATAC-seq专题 单细胞测序专题 CUT&Tag专题 甲基化专题 |