NEWS
新闻资讯
|
项目文章|IF=9.2 & ChIP-seq解析转录因子STAT3在代谢性脂肪性肝病中的调控机制
华中科技大学同济医学院同济医院内科心内科吕家高和老年病科张存泰团队在《International Journal of Biological Sciences》(IF=9.2)杂志发表题为“The role of STAT3/VAV3 in glucolipid metabolism during the development of HFD-induced MAFLD”文章,通过ChIP-seq、RT-PCR等技术探究转录因子STAT3/VAV3在代谢性脂肪性肝病(MAFLD)发展过程中的调控机制,为MAFLD的治疗探寻新的潜在治疗靶点。 一、研究背景 代谢性相关脂肪性肝病(MAFLD),又称非酒精性脂肪性肝病(NAFLD),是一种多因素诱发的慢性肝病。之前研究表明,在MAFLD的发展过程中,STAT3在肝脏中被激活,STAT3一旦被激活,它就会磷酸化(P-STAT3),后形成二聚体转运到细胞核,并作为转录因子发挥对应调控作用。在MAFLD中观察到糖脂代谢紊乱,以及STAT3的激活,然而,其具体机制尚不清晰。 二、研究思路 在此研究中,作者首先通过WB免疫荧光发现HFD诱导STAT3的激活。同时,检测到血糖异常,GLUT4膜定位异常。然而,STAT3激活是否以及如何导致GLUT4的转运异常还需要进一步研究。 接着作者利用ChIP-seq对HFD喂养的ApoE敲除小鼠肝脏组织STAT3下游靶基因进行探究,下游目的基因中关注到名为VAV3的一种特异性鸟嘌呤核苷酸交换因子(GEF)。因此,推测活化的STAT3通过调控VAV3调控GLUT4易位。作者通过免疫组化、磷酸化WB、RT_PCR进行对应验证。小鼠实验显示在HFD下恢复VAV3的表达对MAFLD和减轻糖脂代谢和肝脏炎症存在一定的效用。
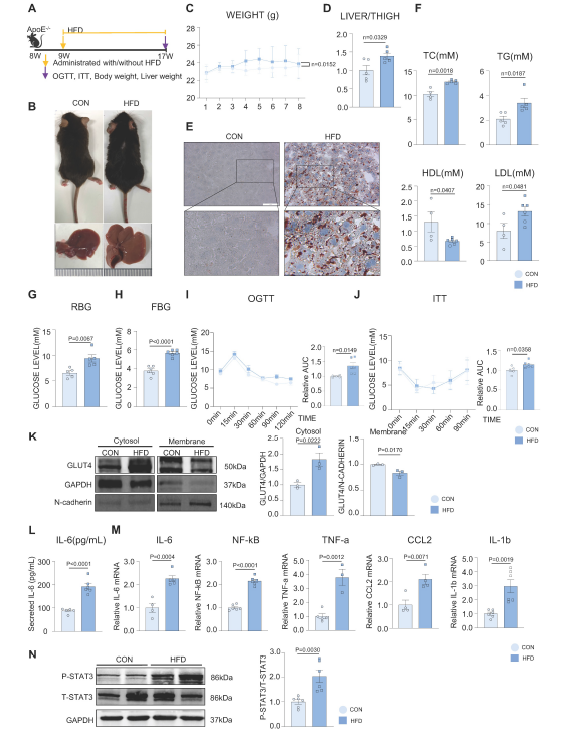
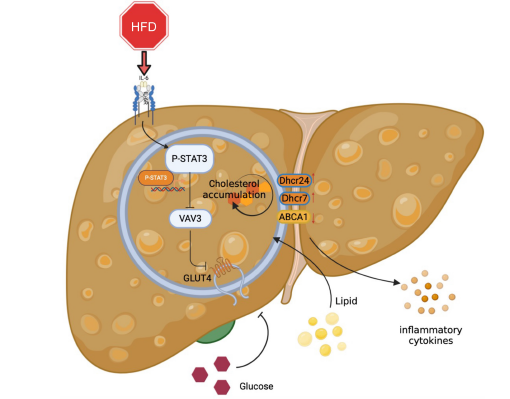
研究路线图 三、研究结果 1. HFD破坏糖脂代谢,诱导慢性炎症 构建HFD诱导的MAFLD模型。饲喂HFD 8周后,与对照组(CON)相比,HFD组小鼠皮毛逐渐变油腻,体重增加(图1B-C)。HFD组肝脏体积和肝脏重量/胫骨长比明显高于CON组(图1B, 1D)。油红O染色证实HFD诱导的肝脏脂肪变性,HFD组的脂滴积累多于CON组(图1E)。血清总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白(LDL)水平显著升高,高密度脂蛋白(HDL)水平显著降低。(图1F)。与CON组相比,HFD组的随机血糖和空腹血糖水平均升高,且HFD诱导糖耐量和胰岛素异常(图1G-J)。 作者采用胞质-膜蛋白分离法检测到GLUT4在细胞内的易位缺陷(图1K)。此外,HFD组小鼠肝脏中IL-6、NF-kB、TNF-a、CCL2、IL-1b等活化炎性因子mRNA水平升高,血清中IL-6分泌水平升高(图1L-M)。STAT3在HFD组的肝组织中也被激活(图1N)。这些结果提示肝脏炎症可能在MAFLD的发展过程中被激活。
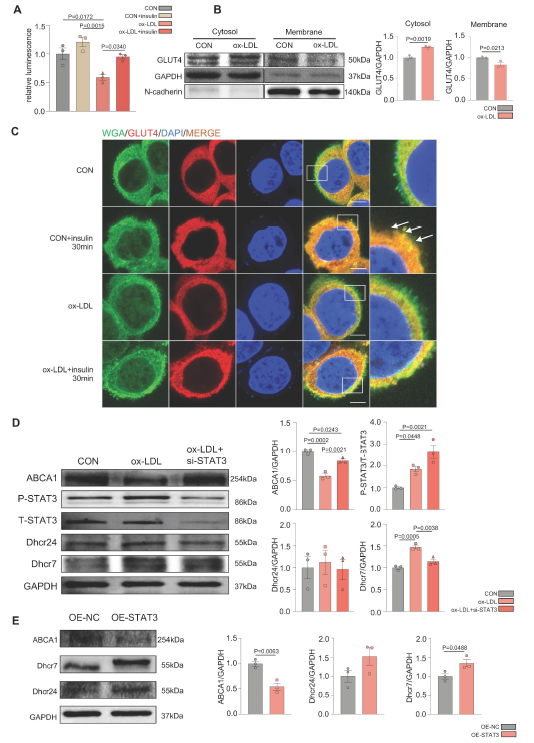
图1 MAFLD模型构建及相关指标检测 2. Ox-LDL在MAFLD的发展过程中诱导STAT3的激活,导致GLUT4运输缺陷和胆固醇积累 为了进一步证明MAFLD在体外的糖脂代谢紊乱,作者利用ox-LDL(氧化性低密度脂蛋白)建立了MAFLD模型。2-脱氧葡萄糖(2-DG)测定显示,在不使用胰岛素的ox-LDL组,肝脏葡萄糖摄取量显著降低,确认ox-LDL诱导了肝脏葡萄糖异常(图2A)。 为了确定葡萄糖代谢紊乱的原因,作者分别在细胞膜和细胞质中检测了GLUT4的分布情况。ox-LDL诱导组细胞质中GLUT4较多,膜中GLUT4较少(图2B)。免疫荧光结果显示GLUT4和膜标记物WGA共定位,也表明GLUT4膜易位缺陷(图2C)。WB结果显示ox-LDL组胆固醇合成酶Dhcr24和Dhcr7水平升高。然而,胆固醇逆向转运蛋白ABCA1的表达水平下降,这意味着胆固醇外排减少。这表明ox-LDL诱导了肝细胞中的胆固醇积累(图2D)。 为了进一步验证ox-LDL诱导的肝脏胆固醇紊乱的刺激是否由于STAT3的激活,利用siRNA敲低STAT3的表达,结果导致胆固醇积累减轻(图2D),而STAT3的过表达加剧了胆固醇的过度积累(图2E)。
图2 Ox-LDL诱导STAT3的激活,使GLUT4运输缺陷且胆固醇积累 3. VAV3可能参与STAT3调控的MAFLD的发展 随后,作者在肝组织中进行了STAT3的ChIP-seq实验,探究STAT3转录调控的参与调节肝脏糖脂代谢的相关靶基因。通过分析筛选得到63个靶标基因,重点关注糖脂代谢和GLUT4转运(图3A)。ChIP-seq的结果显示VAV3受STAT3的直接调控,根据GO和KEGG数据库,VAV3作为一种GEF蛋白与代谢相关,该蛋白可以激活Rho GPTase来调节GLUT4的运输(图3B-D)。Peak可视化展示,STAT3蛋白与VAV3基因结合且有调控作用(图3E)。根据ChIP-seq和JASPAR数据库,通过western blotting和IHC验证HFD组肝组织中VAV3表达降低,P-STAT3表达升高(图3F-G)。这些结果表明,VAV3可能受STAT3调控,参与GLUT4易位,促进MAFLD的发生。
图3 ChIP-seq鉴定VAV3为STAT3靶基因 4. STAT3的过度激活可以抑制VAV3的表达 根据ChIP-seq分析,为了进一步探讨STAT3是否通过抑制VAV3的表达来调控MAFLD的发展,作者敲低STAT3以及特异性磷酸化STAT3的抑制剂statstatic对ox-LDL刺激后的L02细胞进行干预。Ox-LDL诱导下VAV3表达降低;当P-STAT3减少时,VAV3的表达相应增加(图4A-B)。敲低STAT3和过表达STAT3来验证STAT3对VAV3的负调控功能(图4D-E)。
图4 STAT3的激活抑制VAV3的表达 5. VAV3缺乏可引起GLUT4易位缺陷和胆固醇积累 为了确定VAV3是否在调节葡萄糖和胆固醇积累中发挥关键作用,作者使用siRNA和shRNA敲低VAV3,观察到由VAV3缺陷引起的GLUT4膜易位缺陷(图5A-C)。胆固醇合成相关酶Dhcr24、Dhcr7和Cyp51的表达升高,而胆固醇逆向转运蛋白ABCA1的表达降低,表明肝脏VAV3缺乏导致细胞内胆固醇积累(图5D-E)。有趣的是,VAV3缺陷也增加了NF-kB的表达,这可能导致其他细胞损伤,还需要进一步探索(图5D)。然而,在ox-LDL诱导下,采用VAV3过表达质粒可减轻细胞内胆固醇积累(图5F-G)。
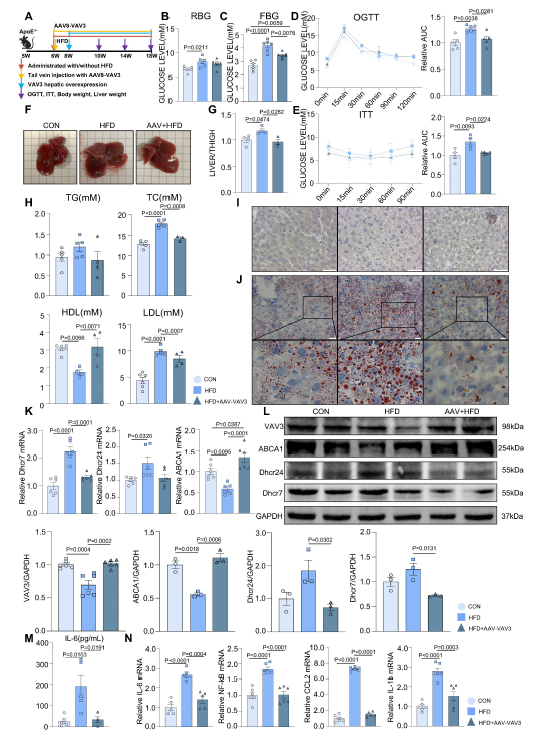
图5 敲低VAV3导致GLUT4转运异常 6. 恢复VAV3的表达可减轻MAFLD在体内的发展 建立小鼠MAFLD模型,(AAV组)在模型组中VAV3进行肝脏特异性过表达 (图6A)。在12周的喂养期间,随机和空腹血糖水平的测量显示,与HFD组相比,AAV组的糖代谢紊乱有显著改善(图6B-C)。此外,OGTT和ITT结果表明,在HFD下,VAV3的过表达改善了HFD组的葡萄糖稳态和胰岛素敏感性受损(图6D-E)。肝脏过表达VAV3也可以减轻HFD引起的体重和肝脏大小的增加(图6F-G)。与HFD组相比,AAV组血清TG、TC、LDL水平均降低,HDL水平升高,表明VAV3过表达可改善MAFLD的脂质代谢(图6H)。qPCR和WB结果显示,与HFD组相比,AAV组在HFD下VAV3过表达减轻了体内胆固醇在细胞内的积聚(图6K-L)。ELISA结果还显示,AAV组血清IL-6水平低于HFD组,qPCR提示AAV可通过恢复HFD下VAV3的表达来抑制肝组织中多种炎症因子(图6M-N)。综上所述,恢复肝脏中VAV3的表达不仅可以减少糖脂异常,还可以抑制肝脏炎症,最终改善MAFLD的发展。
图6 VAV3的表达可减缓MAFLD在体内的发展 四、研究结论 作者通过对ApoE-/-小鼠进行高脂饮食喂养,成功建立了早期代谢相关脂肪肝病(MAFLD)的小鼠模型。研究发现,MAFLD小鼠在高脂饮食后出现了血糖水平的显著增加,同时通过OGTT/ITT测试验证了胰岛素抵抗的存在。此外,研究还发现STAT3和VAV3在MAFLD小鼠中的表达显著增加,并且通过ChIP-seq以及RNA干扰和转染实验证明了STAT3和VAV3在MAFLD发展中的重要作用。此外,研究还发现通过AAV8-TBG-VAV3的尾静脉注射可以在肝脏中过表达VAV3。该研究揭示了STAT3和VAV3在MAFLD发展中的重要作用,并为进一步研究MAFLD的发病机制和治疗提供了新的线索。
图7 STAT3/VAV3轴参与的MAFLD的发展机制 · 爱基百客王牌产品ChIP-seq简介 · · ChIP-seq相关介绍 · ChIP-seq技术将染色质免疫共沉淀和二代测序技术结合,是研究体内蛋白质与DNA相互作用的有力工具,可用于组蛋白修饰、RNA聚合酶、转录因子和辅因子以及G4链体(G4)等方面的研究,技术成熟稳定。爱基百客ChIP-seq可提供:
Peak分析: Peak注释和分布分析,Peak关联基因的GO、KEGG的注释和富集分析, 转录因子和Motif分析等。 多样本差异分析:差异 Peak 分布情况统计,差异 Peak 关联基因GO、KEGG 功能注释与富集,转录因子预测,Motif 预测等。 · 后续验证 01 ChIP-qPCR 分析组蛋白修饰/转录因子与染色质区域的结合情况,揭示染色质状态和基因表达调控之间的关系,真实反映结合特性。 02 EMSA 基于DNA-蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中的迁移率不同,检测活化的与DNA结合的蛋白转录或调节因子。 03 双荧光素酶报告实验 检测转录因子与靶启动子的特异结合。
ChIP-seq和转录组关联分析可以做以下2个方面的研究: 1、DNA结合蛋白和基因表达调控:通过ChIP-seq技术可以确定DNA结合蛋白(如转录因子)的结合位点,然后与转录组数据结合分析,可以获得转录因子直接调控的靶基因,为全面理解转录因子调控功能提供依据。 2、组蛋白修饰和基因表达:ChIP-seq可以用于鉴定组蛋白修饰的位点,结合转录组数据可以了解这些修饰对基因表达的影响。 · 爱基百客ChIP-seq三大优势 优势一:项目经验丰富,研究物种200+种,累计实验2000余次。全面覆盖医口和农口等不同样本,不惧特殊样本(如脂肪组织、高淀粉组织和真菌类),抗体经验也极其丰富(多种组蛋白修饰、转录因子、标签抗体以及p300和RNApol II等均有涉及); 优势二:提供前期实验设计、测序、分析以及后期验证(ChIP-qPCR、EMSA)一站式服务; 优势三:项目文章多次发表于Cancer Cell、Nature Plants、Nature Metabolism以及Plant Cell等期刊。
了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |