NEWS
新闻资讯
|
项目文章| Plant Cell&DAP-seq解析草莓NAC转录因子FvRIF的调控网络
DAP-seq是一种体外研究蛋白与DNA结合的技术,该技术利用麦胚乳表达体系表达目标蛋白然后与基因组DNA文库体外孵育,得到目标蛋白的结合信息。与ChIP-seq和CUT&Tag不同,DAP-seq不需要抗体,在植物中应用更为广泛。今天我们分享一篇2023年发表在The Plant Cell(影响因子:10.676)的文章“Deciphering the regulatory network of the NAC transcription factor FvRIF, a key regulator of strawberry (Fragaria vesca) fruit ripening”。 作者发现二倍体草莓Fragaria vesca中的FvRIF是控制果实成熟的关键调节因子,FvRIF的敲除突变导致果实不能成熟发育。DAP-seq与转录组结合表明,2080个基因是FvRIF介导的调控的直接靶点,包括与果实成熟的各个方面相关的基因。研究表明,FvRIF通过直接调节相关核心基因来调节花青素生物合成和果实成熟。此外,还证明FvRIF与MAP激酶6(FvMAPK6)相互作用并作为其底物,MAP激酶6通过在Thr-310磷酸化FvRIF来调节FvRIF。研究结果揭示了FvRIF介导的转录调控网络在控制草莓果实成熟中的作用,并强调了磷酸化修饰对FvRIF成熟活性的生理意义。爱基百客提供了DAP-seq的分析支持。
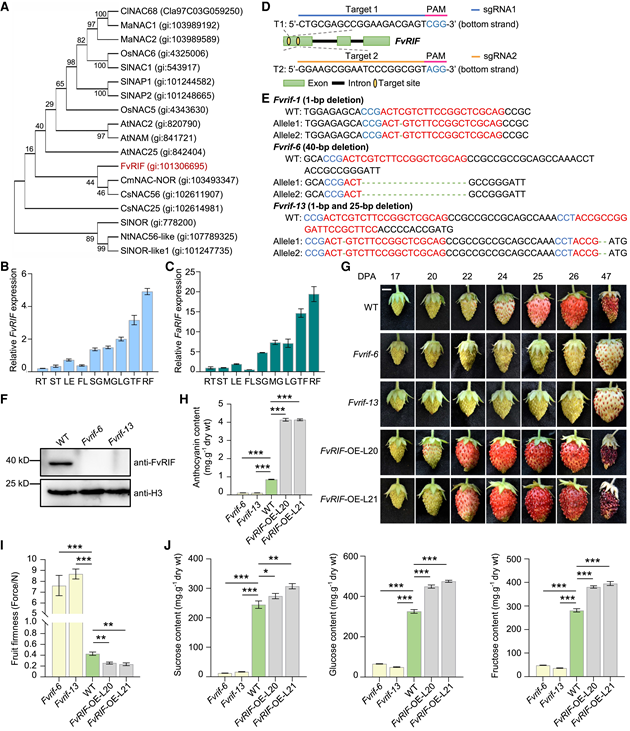
1. 草莓果实成熟控制的主调节因子FvRIF 作者在二倍体草莓的基因组中鉴定了 FvRIF (FvH4_3g20700),它是来自 F. × ananassa (maker-Fvb3-4-augustus-gene-182.31) 的 FaRIF 的直系同源物,与 FaRIF 具有 100% 的蛋白质序列同一性。系统发育分析表明,FvRIF 与甜瓜 (Cucumis melo) 中的 CmNAC-NOR(未成熟)和甜橙 (Citrus sinensis) 中的 CsNAC56 关系最密切,其次是番茄 (Solanum lycopersicum) 中的 SlNOR 和 SlNOR-like1 以及 NtNAC56-like烟草(Nicotiana tabacum)中(图 1A)。作者通过RT-qPCR分析了F. vesca和F. × ananassa中的RIF表达,结果表明FvRIF在果实中高表达,并在二倍体草莓的成熟过程中增加(图1B)。作者还通过CRISPR/Cas9敲除得到突变体植株Fvrif-6和Fvrif-13;Fvrif-6和Fvrif-13突变系显示出类似且明显的抑制成熟表型。(图1G)。突变体中的果实未能完全成熟,并在最后成熟阶段保持白色,这表明FvRIF在控制草莓果实成熟中起主要调节作用。与颜色表型一致,在花后28天(DPA),Fvrif品系的果实中花青素含量下降了>90%(图1H)。相反,Fvrif品系的果实软化受到显著抑制,与野生型相比,其果实硬度高出约18倍(图1I)。
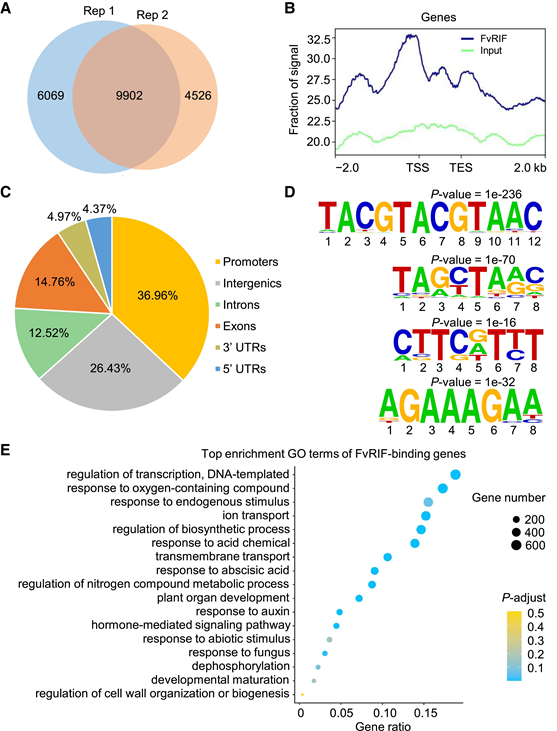
图1:FvRIF的突变导致草莓果实成熟受到抑制 2. FvRIF 结合位点的全基因组鉴定 为了更好地理解FvRIF介导的果实成熟的转录调控,作者进行了DAP-seq来找寻FvRIF结合位点;在两个生物重复中检测到总共9902个富集峰,对应于7899个基因(图2A),并且结合位点高度集中在转录起始位点(TSS)上(图2B);大多数结合位点(37.0%)位于启动子区内(TSS上游2kb)(图2C),这与FvRIF是一种具有DNA结合能力和基因调控活性的TF一致。研究使用Homer工具鉴定了4个富集的基序。最富集的基序由TACGTACGTAAC代表,其占4649个FvRIF结合峰(图2D)。该基序的核苷酸序列为CGT[G/A],这是一种先前报道过的NAC识别基序,证实了DAP-seq数据的可靠性。作者还鉴定出来了另外3个基序,TAGCTA(A/G)C、CTTC(A/G)TTT和AGAAAGAA,它们分别存在于4473、3500和2222个FvRIF结合峰中(图2D)。对含有FvRIF结合位点的基因GO富集分析显示主要在“转录调节”、“植物激素介导的信号通路”、“细胞壁组织或生物发生的调节”和“发育成熟”等过程(图2E),表明FvRIF可能直接控制与果实成熟相关的多种生物通路。
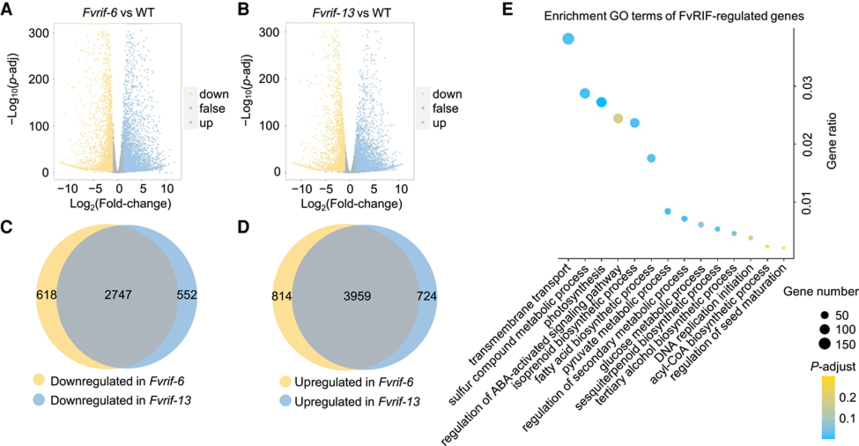
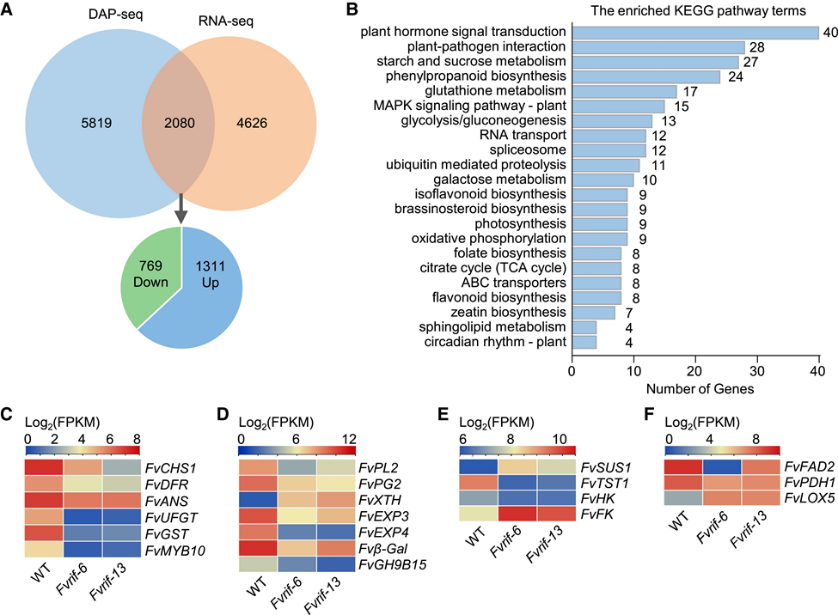
图2:通过DAP-seq进行FvRIF结合位点的全基因组鉴定 3. 通过转录组分析鉴定 FvRIF 调控基因 为了鉴定在果实成熟过程中受 FvRIF 转录调控的基因,作者使用野生型和突变体(Fvrif-6 和 Fvrif-13)的 3 个独立生物重复的果实,通过RNA-seq进行了比较转录组分析。分别得到Fvrif-6与WT的差异基因以及Fvrif-13和WT的差异基因信息。通过韦恩图分析得到共上调2747个基因,共下调3959个基因。GO富集分析得到“ABA激活信号通路的调节”、“次级代谢过程的调节”和“葡萄糖代谢过程”等过程的富集(图3E),证实FvRIF在控制果实发育和成熟中的功能。此外,研究还得到了一些众所周知的成熟相关基因,如编码查尔酮合成酶(CHS)的FvCHS1,参与类黄酮生物合成,编码果胶裂解酶(PL)的FvPL2(负责细胞壁分解)和编码9-顺式-环氧类胡萝卜素双加氧酶的FvNCED5(参与ABA生物合成),在Fvrif系中表现mRNA水平的差异表达。
图3:基于转录组的测定FvRIF的调控基因 4. FvRIF调节的直接靶基因的测定 DAP-seq和RNA-seq联合分析确定 FvRIF 调节的直接靶基因,得到2,080 个共同基因,表明它们是 FvRIF 的直接靶点(图 4A)。其中,769个基因(37.0%)代表FvRIF正向调控的靶标,在Fvrif系中下调,而1,311个基因(63.0%)被认为是FvRIF负向调控的靶标,在Fvrif突变系中上调(图4A)。KEGG通路富集分析表明,FvRIF调控的直接靶基因参与多种代谢通路,包括“植物激素信号转导”、“淀粉和蔗糖代谢”、“苯丙素生物合成”和“类黄酮”生物合成”(图4B)。联合分析结果表明与FvRIF在控制果实成熟中的功能一致,鉴定了与花青素生物合成、细胞壁降解、糖代谢和芳香化合物产生相关的多个基因作为FvRIF的直接靶基因(图4C至F)
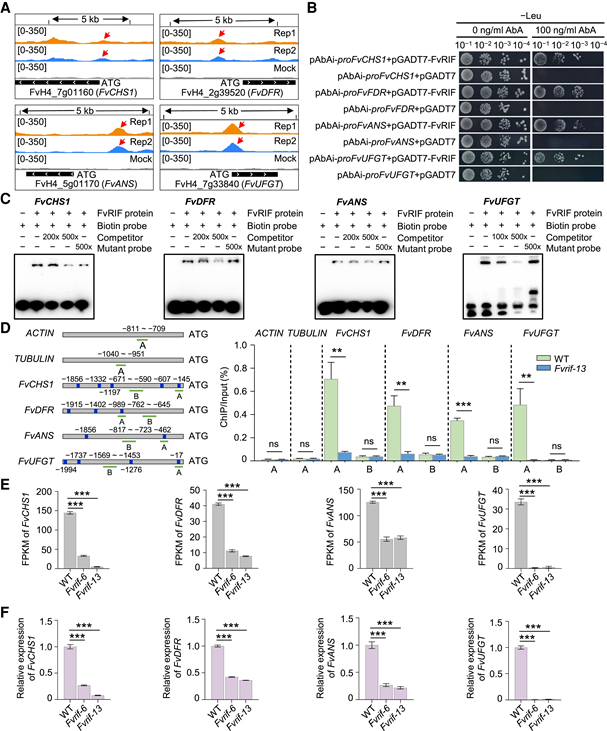
图4:FvRIF直接调控靶基因的鉴定 5. FvRIF直接调控花青素生物合成途径中的关键基因 花青素是草莓果实中的主要色素,由苯丙氨酸解氨酶(PAL)、CHS、查耳酮黄烷酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、二氢黄酮醇4-还原酶(DFR)等一系列酶生物合成。)和无色花青素双加氧酶/花青素合酶(ANS)。花青素生物合成途径中的 6 个基因是 FvRIF 直接调控的靶标(图 4C),这与 Fvrif 果实花青素含量与野生型相比的急剧下降一致(图 4C)。并支持 FvRIF 在此途径中的直接作用。因此,作者选择了4个在DAP-seq分析中启动子区域富集值高的基因,即FvCHS1、FvDFR、FvANS和FvUFGT,并通过体外EMSA实验和体内实验ChIP-qPCR进行了验证。RNA-seq分析显示,与野生型相比,FvCHS1、FvDFR、FvANS和FvUFGT在Fvrif-6和Fvrif-13突变系的果实中的表达显著降低(图5E)。RT-qPCR分析证实了RNA-seq结果(图5F),表明FvRIF正调节这些基因的表达。总之数据表明,FvRIF是草莓果实花青素生物合成的关键正转录调控因子。
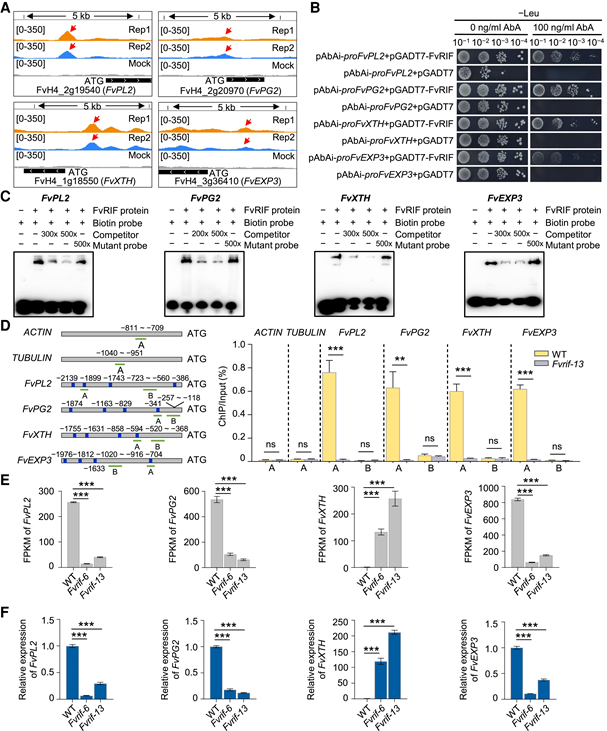
图5:FvRIF介导的草莓花青素生物合成基因的直接调控 6. FvRIF 直接调节参与果实软化的核心基因 果实软化是由一组细胞壁降解酶催化的,是果实成熟过程中最重要的特征之一。DAP-seq 与 RNA-seq 分析确定了参与果实软化的 7 个基因作为直接 FvRIF 调节的靶标(图 4D)。作者选择了其中 4 个基因进行验证:PL 基因 FvPL2、多聚半乳糖醛酸酶 (PG) 基因 FvPG2、木葡聚糖内转葡糖基酶/水解酶基因 FvXTH 和扩展蛋白 (EXP) 基因 FvEXP3。在 DAP-seq 分析中,所有 4 个基因在其启动子区域均显示富集峰(图 6A)。Y1H分析表明FvRIF与所选基因的启动子相互作用(图6B)。此外,EMSA和ChIP-qPCR测定证实FvRIF可以在体外和体内直接结合这些基因的启动子(图6C和D)。RNA-seq和RT-qPCR分析显示,与野生型相比,Fvrif-6和Fvrif-13突变系的FvPL2、FvPG2和FvEXP3基因显著下调,表明Fvrif正调节这些基因。相反,FvXTH显示出相反的表达模式(图6,E和F),这与其之前报道的与果实软化的负相关一致。总之,这些结果表明,FvRIF在直接控制草莓果实软化相关基因方面起着正转录调节因子的作用。
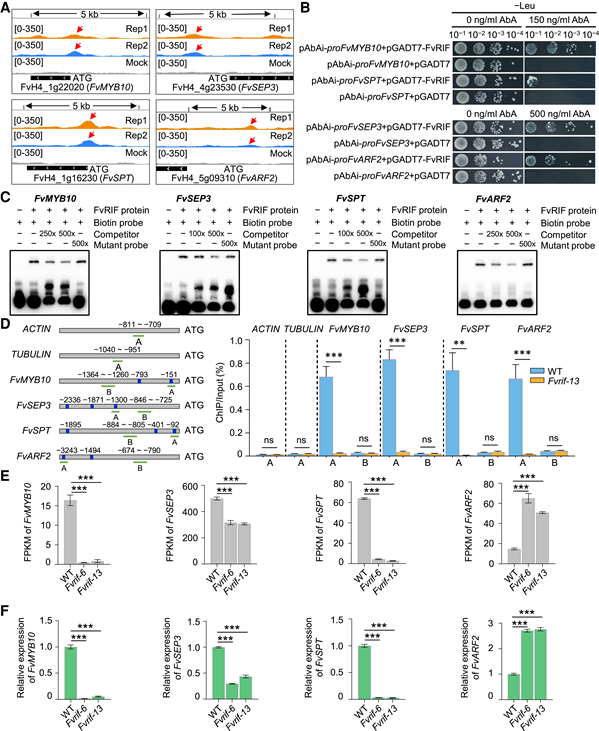
图6:FvRIF介导的果实软化相关基因的直接调控 7. FvRIF直接调控参与果实成熟的TF基因 DAP-seq与RNA-seq相结合揭示了总共137个TF编码基因作为 FvRIF 的直接靶标。这些 TF 基因中只有 4 个:FvMYB10、FvSEP3、FvSPT 和 FvARF2 先前被报道参与草莓成熟的调控。FvMYB10 是花青素生物合成的关键正向调节因子, FvSEP3(一种 MADS-box TF)和 FvSPT (Spatula),一种基本螺旋-环-螺旋 (bHLH) ) TF 对于调节果实发育和成熟是必需的。相比之下,FvARF2 对果实成熟和质量产生负向调节作用。DAP-seq 分析揭示了这 4 个 TF 基因启动子区域的 FvRIF 结合峰(图 7A)。通过酵母中的 Y1H 分析检测到 FvRIF 和所有 4 个基因的启动子之间的相互作用(图 7B)。还进行了EMSA和ChIP-qPCR测定,这支持了FvRIF在体外和体内特异性结合这些TF基因的启动子的观点(图7,C和D)。通过RNA-seq进行的表达分析(图7E)和RT-qPCR(图7F)显示,相对于野生型,在突变系(Fvrif-6和Fvrif-13)的果实中,FvMYB10、FvSEP3和FvSPT表现出降低的表达水平,而FvARF2表现出增加的表达水平。这些结果表明,FvRIF在控制果实成熟方面发挥作用。
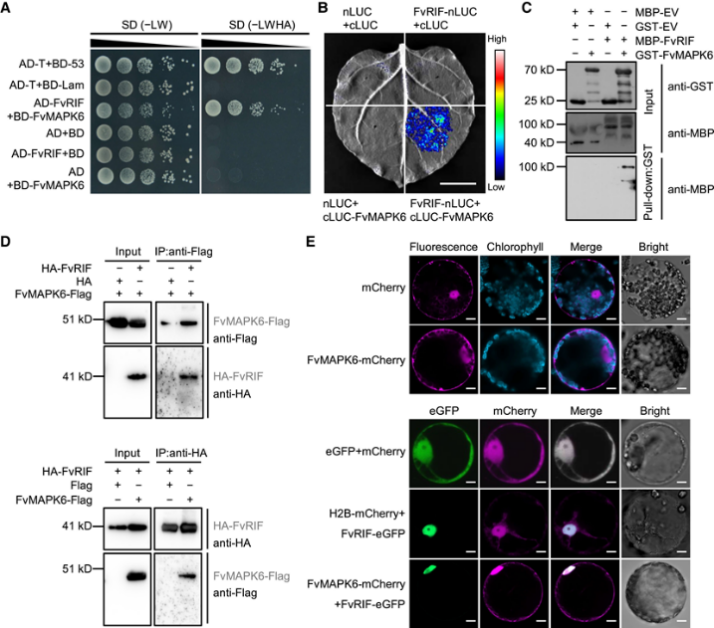
图7:FvRIF介导的TF基因在果实成熟过程中的直接调控 8. FvRIF 与 FvMAPK6 相互作用 作为一种经典的翻译后修饰,蛋白质磷酸化调节 TF 的活性。作者通过 KinasePhos (http://kinasephos.mbc.nctu.edu.tw/predict.php) 对 FvRIF 中的磷酸化位点进行了预测分析。该分析预测 Thr-310 是一个假定的磷酸化位点,其同源激酶似乎是 MAPK。因此,作者假设 FvRIF 可能受到 MAPK 介导的磷酸化;用 F. vesca 中注释的 12 个 MAPK 蛋白针对 FvRIF 进行了酵母双杂交(Y2H),结果表明 FvRIF 与 FvMAPK6 相互作用,但不与任何其他 MAPK 相互作用(图 8A)。然后还利用双荧光素酶证实了这一观点(图 8B、E),这表明 FvRIF 与FvMAPK6相互作用。
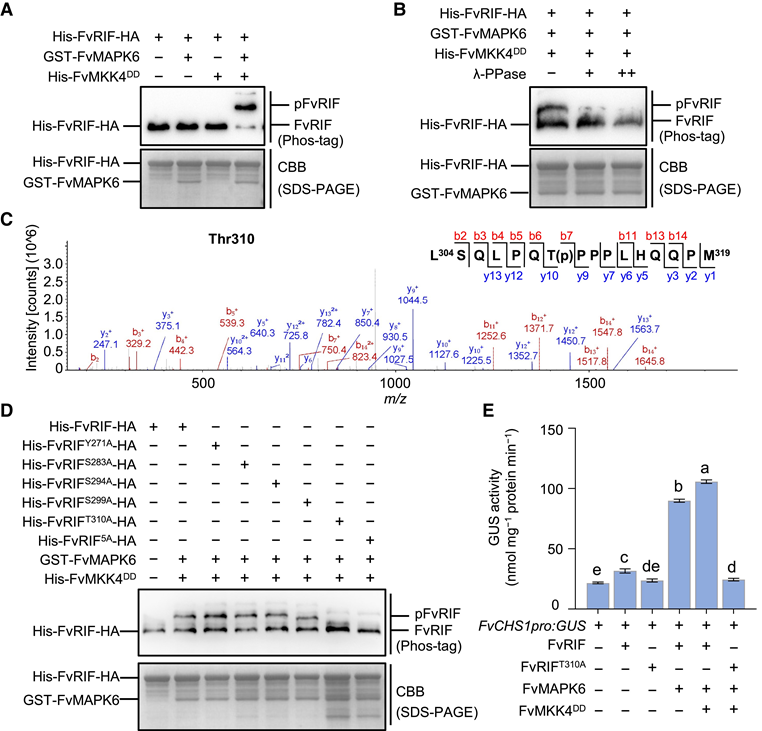
图8:FvRIF和FvMAPK6之间的相互作用 9. FvMAPK6 在 Thr-310 磷酸化 FvRIF 作者使用 Phos-tag SDS–PAGE研究 FvRIF 是否被 FvMAPK6 磷酸化;其中用激酶 FvMKK4 作为假定的激活剂。如图9A所示,在没有被组成型活性变体FvMKK4DD激活的情况下,FvMAPK6不能磷酸化FvRIF,这表明FvMAPK6通过其上游激酶FvMKK4磷酸化诱导的激活的重要性。重要的是,FvMKK4DD 的存在导致 FvRIF (pFvRIF) 磷酸化,如 Phos-tag 凝胶中的迁移率变化所证明的那样 (图 9A)。此外,在存在 lambda 磷酸酶 (λ-PPase) 的情况下,磷酸化形式的丰度降低(图 9B),这证实了上部条带确实是由 FvMKK4-FvMAPK6 模块激活导致的磷酸化 FvRIF。 然后,作者对磷酸化FvRIF进行LC-MS分析,从而鉴定出5个高置信度磷酸化位点,Tyr-271、Ser-283、Ser-294、Ser-299和Thr-310(图9C)。定点突变分析显示,所有5个磷酸化位点(FvRIF5A)的突变显著降低了FvMAPK6依赖性pFvRIF(图9D)。进一步的分析表明,只有FvRIFT310A(Thr-310被丙氨酸取代[A])在FvMAPK6诱导的FvRIF磷酸化中表现出显著降低,而FvRIFY271A、FvRIFS283A、FvRIFS294A和FvRIFS299A表现出很少的作用(图9D),表明Thr-310是负责FvMAPK5介导的pFvRIF的关键位点。 最后,为了确定FvRIF的转录活性是否受其磷酸化状态的调节,作者进行了GUS转录活性测定。结果如图9E所示,FvRIF激活了GUS的转录。还得出FvMAPK6依赖性pFvRIF显著增加了GUS转录,而FvRIFT310A变体完全消除了FvCHS1pro:GUS报告子的反式激活(图9E)。总之,这些数据表明,FvMKK4–FvMAPK6模块在Thr-310处的pFvRIF对正向调节其活性至关重要。
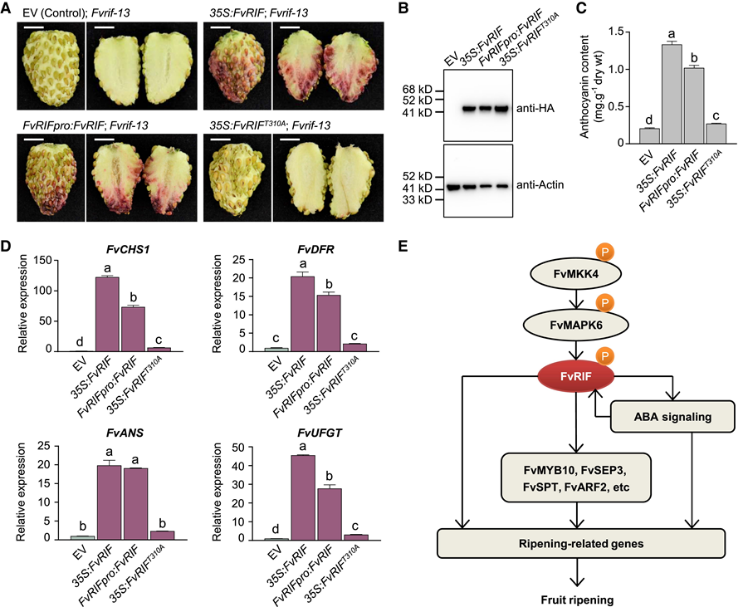
图9:FvMAPK6介导的FvRIF磷酸化发生在Thr-310 10. 草莓中 FvRIF 的激活离不开磷酸化 为了确认 FvRIF 磷酸化在体内调节其活性,作者在 Fvrif-13 突变体的果实中瞬时表达了各种构建体:完整的 FvRIF或其突变变体 FvRIFT310A,其中关键磷酸化位点(Thr-310)突变为A。如图10A所示,完整的FvRIF而非其突变变体FvRIFT310A挽救了Fvrif-13突变体的成熟缺陷。WB证实了FvRIF和FvRIFT310A的表达(图10B)。在瞬时表达完整FvRIF的Fvrif-13突变体的果实中,花青素含量显着增加(图10C),同时参与花青素生物合成的基因表达水平增加,包括FvCHS1、FvDFR、FvANS和FvUFGT(图10C、D)。相比之下, Fvrif-13突变体果实中花青素含量或基因表达几乎没有变化。 基于研究结果,作者提出了一个FvRIF介导的草莓果实成熟转录调控模型(图10E)。在草莓果实成熟过程中,蛋白激酶FvMAPK6作用于FvMKK4的下游,磷酸化FvRIF,从而促进其转录活性。激活的FvRIF通过直接或在ABA依赖性途径中调节成熟相关基因来控制果实成熟,这反过来又通过正调控FvRIF的表达。FvRIF还通过靶向许多TF基因(即FvMYB10、FvSEP3、FvSPT和FvARF2)发挥作用,这些基因通过控制成熟相关基因来调节果实成熟。
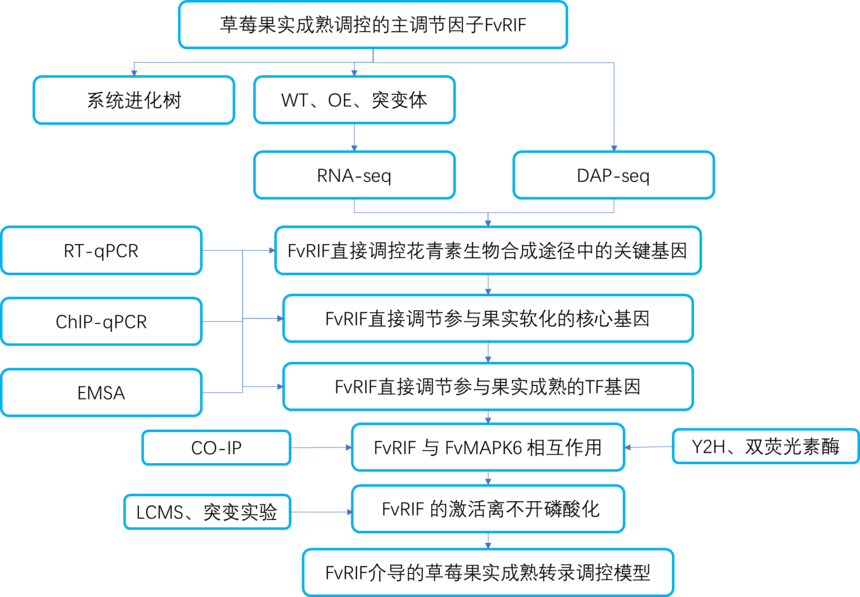
图10:FvRIF磷酸化是其在草莓中活化所必需的 NAC转录因子 FvRIF被认为是草莓果实成熟的关键调节因子,作者通过DAP-seq和RNA-seq得到FvRIF调控草莓花青素生物合成途径中的关键基因、参与果实软化的核心基因、参与果实成熟的TF基因;并通过ChIP-qPCR、EMSA、RT-qPCR进行了验证。还利用CO-IP、酵母双杂以及双荧光素酶验证FvRIF与与 FvMAPK6互作,并且通过LC-MS等实验得出FvRIF 的激活离不开磷酸化;提出了FvRIF介导的草莓果实成熟转录调控模型。该研究为我们提供了转录因子经典的上下游研究思路,大家可以参考着设计实验哦,有做转录因子相关的实验可以找爱基百客。
项目咨询
了 解 更 多 { 往 期 精 彩 回 顾 } 精选合集,欢迎收藏哟! |