NEWS
新闻资讯
|
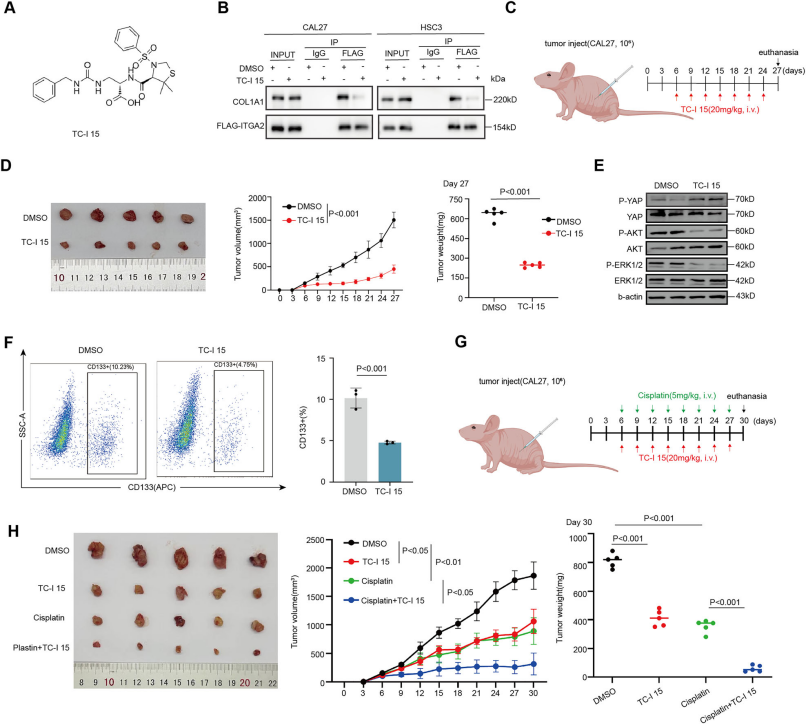
Cell Death项目文章| 转录因子klf7调控ITGA2作为抑制口腔癌干细胞的治疗靶点口腔癌会影响颊黏膜、口底、舌、牙槽嵴、磨牙后三角区和硬腭。其发病率约为每10万人中有1例。最常见的病理类型是口腔鳞状细胞癌(OSCC),占病例的90%以上。早期OSCC(I-II期)通常仅采用手术治疗,而晚期OSCC(III-IV期)由于其易复发和淋巴结转移,预后相对较差,则需要多模式治疗手段。由于早期诊断率低,大多数OSCC患者在确诊时已处于晚期。目前,OSCC的总体生存率仅保持在50%。OSCC常用的化疗药物包括铂类药物、5-氟尿嘧啶(5-FU)、紫杉醇(PTX)和阿霉素(Dox)。然而,大多数患者会对这些药物产生耐药性。目前,耐药性是癌症化疗成功的主要障碍之一,并导致患者出现多种预后不良反应。 口腔癌干细胞(OCSCs)具有长期自我更新的能力,并能够复制原发性癌症中所发现的各种细胞谱系,其容易对治疗产生耐药性,包括传统的化疗和免疫疗法。因此,针对口腔癌干细胞的疗法有望成为克服口腔癌耐药性的一种有效方法。为了减轻口腔鳞状细胞癌中的药物耐药性,有必要加强对口腔癌干细胞的了解,尤其要关注其分子特征。近日,浙江大学医学院第一附属医院朱慧勇及吕炯团队在Cell Death and Disease上发表了一篇名为《KLF7-regulated ITGA2 as a therapeutic target for inhibiting oralcancer stem cells》的文章。该文章采用单细胞分析识别了口腔鳞状细胞癌(OSCC)中干细胞样特征的子集,其特征为具有较高的发育潜力以及激活了干细胞通路。并确定了KLF7是维持口腔鳞状癌干细胞(OCSC)的关键分子。进一步的研究表明,KLF7通过直接转录激活ITGA2(介导细胞-ECM(细胞外基质)相互作用至关重要的膜蛋白)来调节OSCC的干细胞特性。抑制ITGA2可以抑制OSCC的干细胞特性,并显著增强OSCC对顺铂的敏感性。此研究强调了ITGA2是一个有前景的治疗靶点,提供了一种新颖的抗癌干细胞策略。爱基百客为该研究提供ChIP-seq的技术支持。 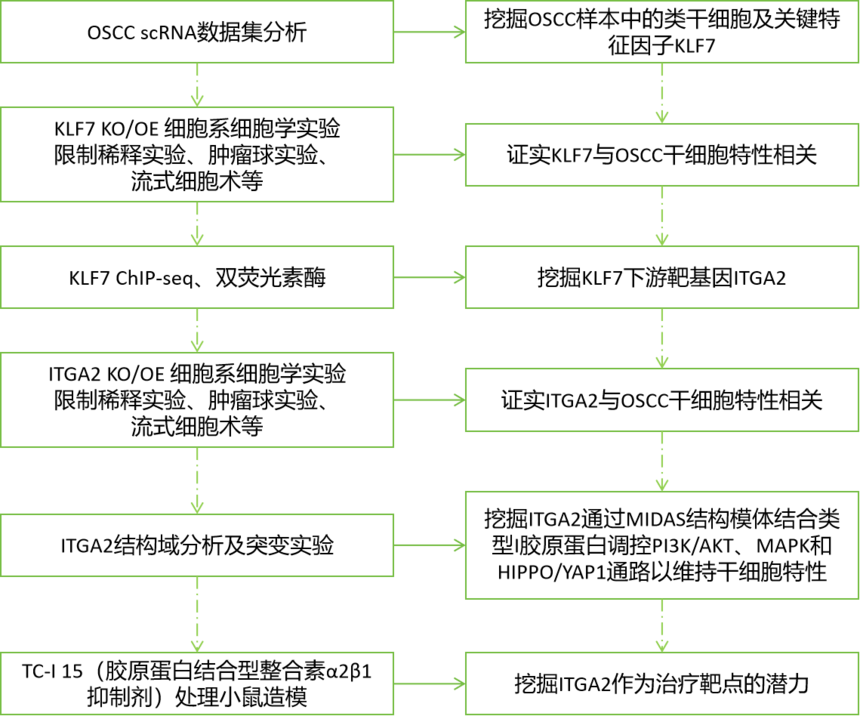 一、口腔鳞状细胞癌中癌干细胞的鉴定及维持干细胞特性的关键分子的研究 为了确定口腔鳞状细胞癌(OSCC)中癌干细胞(CSCs)的关键分子,作者分析了来自公共数据库的10个OSCC样本的单细胞转录组数据。具有CNV大于0.1的上皮来源细胞被认定为恶性细胞,并进一步细分为亚型。利用GSVA对每个簇进行了功能注释,其中S1被认定为干细胞样亚型,表现出最高的发育潜力、最高的干细胞基因表达活性以及最强的侵袭特性。表明S1细胞内的细胞具有所有肿瘤细胞中最高的干细胞样特性。 在这种类似干细胞的亚型及与干细胞相关的通路(Notch、Wnt和Hippo通路)中,KLF7在OSCC中过度表达,并且与不良预后相关,最近的研究表明,KLF7能够重建造血干细胞微环境,这表明KLF7可能是维持OSCC中干细胞特性的关键分子。免疫荧光染色显示KLF7、CD44和CD133(肿瘤干细胞标志物)的分布是一致的。这些发现表明,KLF7表达水平的升高与OSCC的干细胞特性有关。 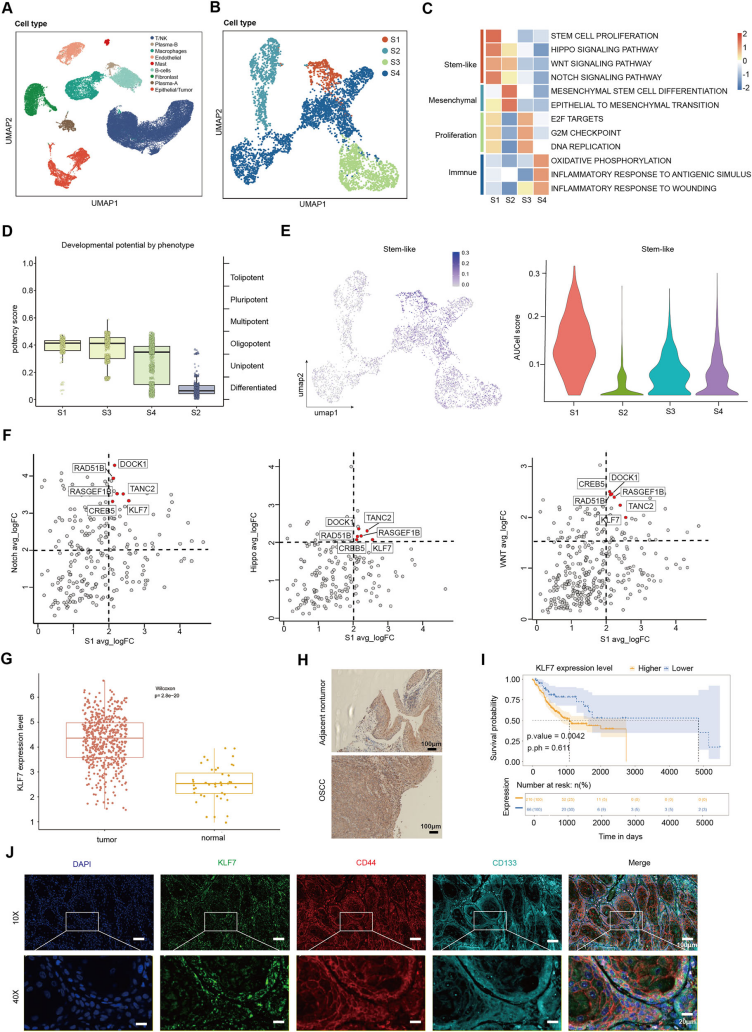 图1:口腔癌中癌干细胞的鉴定及维持干细胞特性的关键分子的研究 二、KLF7调控口腔鳞状细胞癌的干细胞特性及迁移能力 为了进一步确认KLF7是否能调节OSCC的干细胞特性,作者构建了KLF7缺失的OSCC细胞系(CAL27和HSC3)。发现KLF7缺失显著降低了NANOG(维持干细胞特性的关键转录因子)的表达。此外,KLF7缺失后,CSC的频率显著降低。肿瘤球的大小和数量显著减少,表明其自我更新能力受损。流式细胞术分析显示,KLF7缺失导致CD133+细胞的比例降低,并且醛脱氢酶(ALDH)活性受损。相反,KLF7的过表达导致NANOG表达增加、肿瘤球形成增强以及CD133+细胞比例和ALDH活性增加。但KLF7缺失并不影响细胞增殖。鉴于已报道的上皮-间质转化(EMT)与癌干细胞特征之间存在重叠现象,作者分析了KLF7、迁移以及EMT之间的关系。KLF7的敲低与伤口愈合速度降低、迁移细胞数量减少、波形蛋白表达降低以及E-钙粘蛋白表达增加有关,而过表达KLF7的CAL27和HSC3细胞系增强了伤口愈合速度和迁移细胞数量。总的来说,KLF7在调节口腔鳞状细胞癌的干细胞特性以及迁移方面起着关键作用。 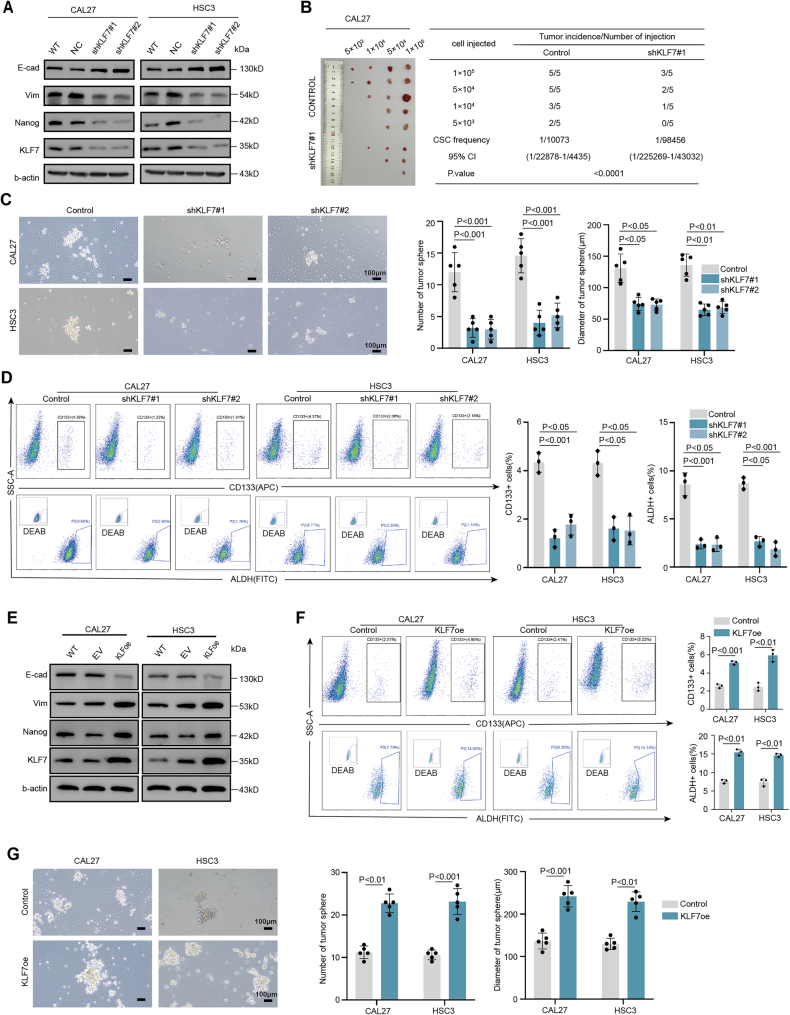 图2:KLF7可抑制口腔鳞状细胞癌的干细胞特性及迁移能力 三、与干细胞特性相关的基因ITGA2位于KLF7的下游位置 KLF7是一种能够激活下游基因的转录因子,但其直接用于药物靶向治疗存在挑战。为了确定具有治疗潜力的下游靶基因,作者进行了染色质免疫沉淀测序(ChIP-seq)分析,重点关注可能适用于药物开发的蛋白质。利用启动子区域的富集情况以及类干细胞的子集和干细胞相关通路中富集情况筛选,作者挖掘到了ITGA2基因。ITGA2在口腔鳞状细胞癌(OSCC)中高度表达,并与不良预后相关。双荧光素酶实验确定了KLF7对ITGA2的直接调控作用,而免疫荧光染色显示ITGA2、KLF7、CD44和CD133的分布一致,进一步支持了KLF7、ITGA2和干细胞特性之间的联系。 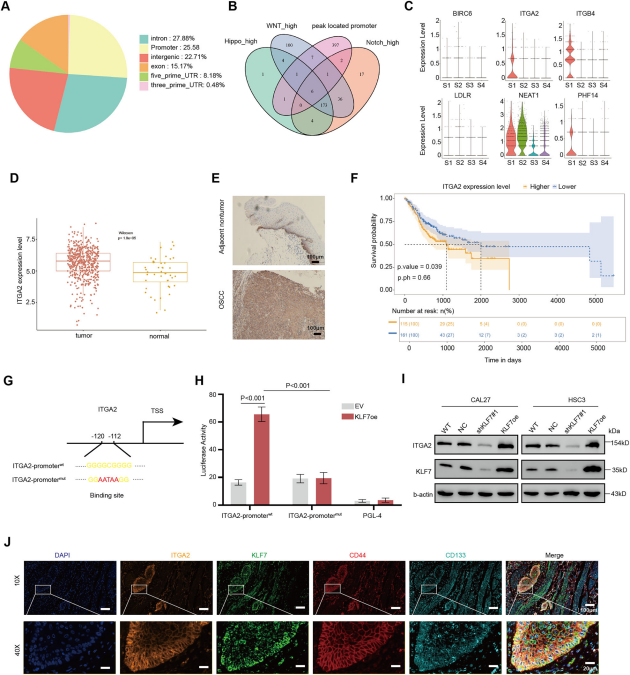 图3:与细胞骨架相关的ITGA2是KLF7的下游基因 四、ITGA2调控OSCC的干性和迁移 为了研究ITGA2是否调控OSCC的干细胞性,作者建立了ITGA2敲低的CAL27和HSC3细胞系。ITGA2敲除后CSC频率显著降低,肿瘤球的大小和数量均显著减少,这表明癌干细胞的自我更新能力受到了抑制。流式细胞术分析进一步表明,ITGA2敲除降低了CD133+细胞的比例,并降低了ALDH活性。与KLF7的调节作用一致,ITGA2敲除减缓了伤口闭合速度,并减少了迁移细胞的数量,但对CAL27和HSC3细胞的增殖能力没有影响。接下来,作者在KLF7缺失的细胞系中过量表达ITGA2。ITGA2的过表达逆转了KLF7缺失所导致的肿瘤球大小和数量的减少、CD133+细胞比例的降低、ALDH活性的下降、伤口愈合情况的恶化以及迁移细胞数量的减少。这些发现凸显了KLF7/ITGA2轴在调节口腔鳞状细胞癌的干细胞特性及迁移方面所起的关键作用。 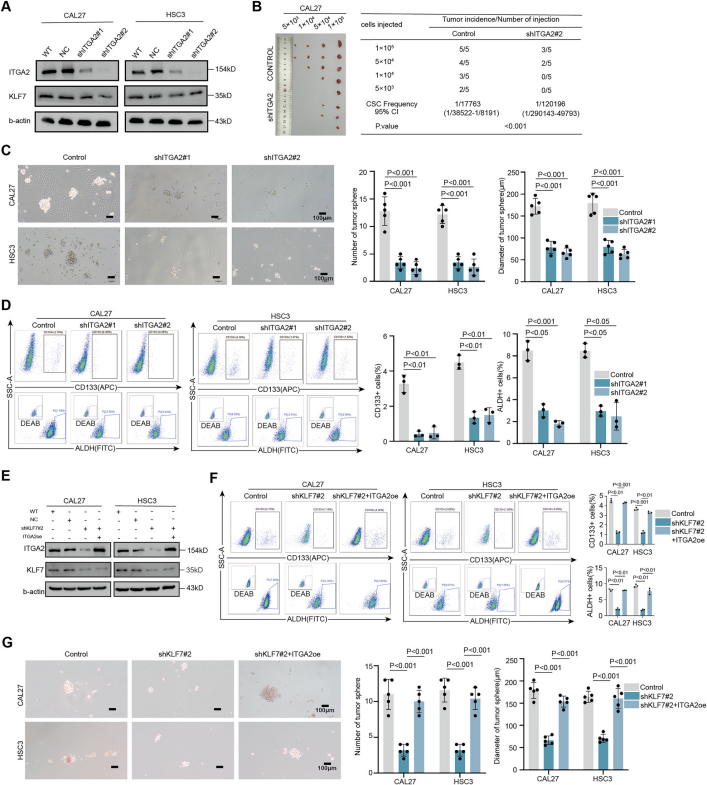 图4:抑制性蛋白ITGA2可抑制口腔鳞状细胞癌的干细胞特性 五、ITGA2与I型胶原蛋白结合,从而驱动YAP进入细胞核并激活干细胞相关通路 作为整合素家族的一员,ITGA2通过响应细胞外基质的机械刺激发挥作用。基于对Notch、Hippo、WNT、AKT和MAPK信号通路中差异表达基因(DEGs)的单细胞分析,作者发现ITGA2可能与Hippo、MAPK和AKT信号通路的激活有关。敲低ITGA2会降低AKT和ERK1/2的磷酸化水平,增加YAP1的磷酸化,并导致YAP1从细胞核中输出。ITGA2在头部区域包含一个额外的结构域(“A”或“I”),该结构域具有一个保守的金属离子依赖性黏附位点(MIDAS)结构模体,这对于在I型结构域的C端处与配体结合至关重要。突变研究表明,MIDAS结构模体以及周围表面暴露的侧链对于配体结合是必需的。 ITGA2介导细胞与细胞外基质(ECM)之间的相互作用,其中类型I胶原蛋白是主要的ECM成分。为了探究ITGA2是否与类型I胶原蛋白相互作用并激活与干细胞特性相关的通路,作者构建并转染了带有ITGA2高表达(OE)或ITGA2突变体(MIDAS突变体)的OSCC细胞。免疫沉淀(IP)结果证实了ITGA2与COL1A1之间的相互作用,而在ITGA2突变体中这种相互作用被消除。当向培养基中添加类型I胶原蛋白时,AKT和ERK1/2的磷酸化增加,YAP1的磷酸化水平降低,导致YAP1进入细胞核。而在ITGA2突变体中则相反。这些发现表明,ITGA2的MIDAS结构域在结构上与类型I胶原蛋白相互作用,从而激活PI3K/AKT、MAPK和HIPPO/YAP1通路,以维持OSCC的干细胞特性。 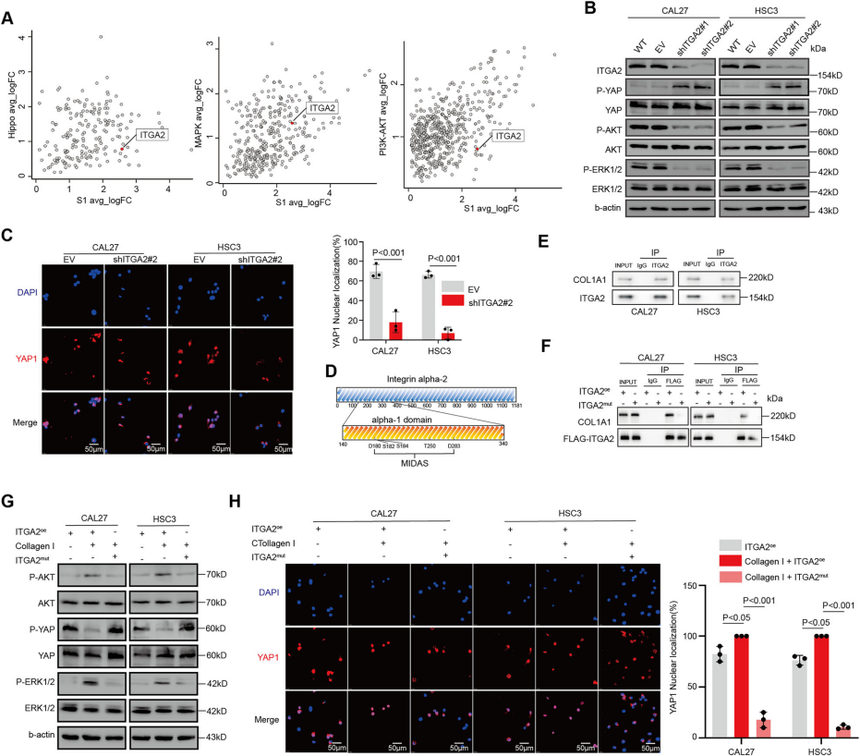 图5:ITGA2与I型胶原蛋白结合,从而驱动YAP进入细胞核并激活干细胞相关通路 六、TC-I 15能抑制口腔鳞状细胞癌,并增强口腔鳞状细胞癌对化疗的敏感性 TC-I 15是一种别构性的胶原蛋白结合型整合素α2β1抑制剂,其与GFOGER和GLOGEN结合的半最大抑制浓度(IC50)值分别为26.8μM和0.4μM。在类型I胶原蛋白与整合素α2β1结合的过程中,整合素α2的I域会协调一个二价阳离子(Mg2+)在其MIDAS中。整合素α2β1与类型I胶原蛋白的三螺旋结构(GFOGER)之间的相互作用的晶体结构已经确定。GFOGER基序和整合素I域通过与Mg2+的配位形成复合物,这一机制强调了谷氨酸(E)羧酸侧链在GxOGEx序列(包括GLOGEN)中的关键作用,对于整合素介导的结合至关重要。因此,作者选择了TC-I 15进行实验,以评估针对ITGA2的靶向治疗口腔鳞状细胞癌(OSCC)的可行性。免疫沉淀实验表明,TC-I 15干扰了ITGA2与类型I胶原蛋白之间的结合。随后作者将CAL27细胞植入裸鼠体内,从接种后第6天开始,每隔3天静脉注射TC-I 15,同时定期测量肿瘤体积,发现TC-I 15显著降低了肿瘤大小、生长速度和肿瘤重量。此外,TC-I 15降低了AKT和ERK1/2的磷酸化水平,增加了YAP1的磷酸化水平,以及降低了由CD133+细胞确定的细胞数量。 鉴于癌干细胞在肿瘤耐药性中的关键作用,作者进一步研究了TC-I 15是否能提高口腔鳞状细胞癌对化疗的敏感性。作者将CAL27细胞植入裸鼠体内,并从接种后第6天开始,每隔3天静脉注射顺铂和TC-I 15。持续监测并测量肿瘤体积。与单独使用顺铂相比,TC-I 15与顺铂的联合使用显著降低了肿瘤大小、生长速度和肿瘤重量。这些发现表明,TC-I 15可抑制口腔鳞状细胞癌,并提高其对化疗的敏感性,突显了靶向ITGA2以提高临床抗肿瘤疗效的潜力。 图6:TC-I 15能抑制口腔鳞状细胞癌,并增强口腔鳞状细胞癌对化疗的敏感性 CSCs在肿瘤转移、治疗抵抗和免疫逃避中起着至关重要的作用。识别并理解调控肿瘤细胞干细胞性的因素为开发有效的治疗策略提供了巨大的机遇。在关于OSCC的研究中,作者通过单细胞转录组、ChIP-seq、双荧光素酶等实验证实了KLF7在维持OSCC的干细胞性方面起着关键作用。KLF7通过结合ITGA2维持OSCC的干细胞性,而TC-I 15作为一种ITGA2-胶原蛋白相互作用的小分子抑制剂,在异种移植模型中显著增强了口腔鳞状细胞癌OSCC对顺铂的敏感性,ITGA2作为一个有前景的治疗靶点,为抗癌干细胞的治疗提供了新的策略。
项目咨询
{ 往 期 精 彩 回 顾 } |